LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Vista la Directiva 92/65/CEE del Consejo, de 13 de julio de 1992, por la que se establecen las condiciones de policía sanitaria aplicables a los intercambios y las importaciones en la Comunidad de animales, esperma, óvulos y embriones no sometidos, con respecto a estas condiciones, a las normativas comunitarias específicas a que se refiere la sección I del Anexo A, de la Directiva 90/425/CEE [1], y, en particular, su artículo 17, apartado 2, letra b), apartado 3, letra a) y apartado 3, letra c), párrafo primero, su artículo 18, apartado 1, cuarto guión, y su artículo 19,
Vista la Directiva 2002/99/CE del Consejo, de 16 de diciembre de 2002, por la que se establecen las normas zoosanitarias aplicables a la producción, transformación, distribución e introducción de los productos de origen animal destinados al consumo humano [2], y, en particular, su artículo 8 y su artículo 9, apartado 2, letra b), y su artículo 9, apartado 4,
Vista la Directiva 2004/68/CE del Consejo, de 26 de abril de 2004, por la que se establecen normas zoosanitarias para la importación y tránsito en la Comunidad de determinados ungulados vivos, se modifican las Directivas 90/426/CEE y 92/65/CEE y se deroga la Directiva 72/462/CEE [3], y, en particular, su artículo 3, apartado 1, párrafos primero y segundo, su artículo 6, apartado 1, párrafo primero, su artículo 7, letra e), su artículo 8, su artículo 10, párrafo primero, y su artículo 13, apartado 1,
Visto el Reglamento (CE) nº 852/2004 del Parlamento Europeo y del Consejo, de 29 de abril de 2004, relativo a la higiene de los productos alimenticios [4], y, en particular, su artículo 12,
Visto el Reglamento (CE) nº 853/2004 del Parlamento Europeo y del Consejo, de 29 de abril de 2004, por el que se establecen normas específicas de higiene de los alimentos de origen animal [5], y, en particular, su artículo 9,
Visto el Reglamento (CE) nº 854/2004 del Parlamento Europeo y del Consejo, de 29 de abril de 2004, por el que se establecen normas específicas para la organización de controles oficiales de los productos de origen animal destinados al consumo humano [6], y, en particular, su artículo 11, apartado 1, y su artículo 16,
Visto el Reglamento (CE) nº 882/2004 del Parlamento Europeo y del Consejo, de 29 de abril de 2004, sobre los controles oficiales efectuados para garantizar la verificación del cumplimiento de la legislación en materia de piensos y alimentos y la normativa sobre salud animal y bienestar de los animales [7], y, en particular, su artículo 48, apartado 1,
Considerando lo siguiente:
(1) En la Directiva 72/462/CEE del Consejo, de 12 de diciembre de 1972, relativa a problemas sanitarios y de policía sanitaria en las importaciones de animales de las especies bovina, porcina, ovina y caprina y de carne fresca o de productos a base de carne, procedentes de países terceros [8], se preveía la confección de una lista que recogiera los terceros países o partes de terceros países a partir de los cuales los Estados miembros deben permitir la importación de determinados animales vivos y de carne fresca de ciertos animales.
(2) Por consiguiente, se adoptó la Decisión 79/542/CEE del Consejo, de 21 de diciembre de 1976, por la que se confecciona una lista de terceros países o partes de terceros países, y se establecen las condiciones de certificación veterinaria, sanitaria y zoosanitaria, para la importación a la Comunidad de determinados animales vivos y de su carne fresca [9]. En esta Decisión se establecen las condiciones sanitarias para la importación a la Unión Europea de animales vivos, a excepción de los équidos, y para la importación de carne fresca de tales animales, incluidos los équidos, pero excluidos los preparados de carne. En los anexos I y II de la Decisión figuran las listas de terceros países o partes de terceros países desde los que se permite importar a la Unión Europea determinados animales vivos y su carne fresca, así como modelos de certificados veterinarios.
(3) Desde que se adoptara esta Decisión, se han fijado en otros actos de la Unión una serie de nuevos requisitos sanitarios y zoosanitarios que constituyen un nuevo marco legislativo en este ámbito. La propia Directiva 72/462/CEE ha sido derogada por la Directiva 2004/68/CE.
(4) De conformidad con el artículo 20 de la Directiva 2004/68/CE, las normas de aplicación en materia de importaciones establecidas en las decisiones que se adoptaron con arreglo a la Directiva 72/462/CEE, entre otras la Decisión 79/542/CEE, deben seguir en vigor mientras no hayan sido sustituidas por las medidas que se adopten en el nuevo marco legislativo.
(5) Con arreglo a lo dispuesto en el artículo 4, apartado 3, de la Directiva 2004/41/CE del Parlamento Europeo y del Consejo, de 21 de abril de 2004, por la que se derogan determinadas directivas que establecen las condiciones de higiene de los productos alimenticios y las condiciones sanitarias para la producción y comercialización de determinados productos de origen animal destinados al consumo humano y se modifican las Directivas 89/662/CEE y 92/118/CEE del Consejo y la Decisión 95/408/CE del Consejo [10], una vez que se adopten las disposiciones necesarias con arreglo a los Reglamentos (CE) nº 852/2004, (CE) nº 853/2004 y (CE) nº 854/2004, o a la Directiva 2002/99/CE, dejarán de aplicarse las normas de aplicación adoptadas con arreglo a la Directiva 72/462/CEE.
(6) La Decisión 79/542/CEE ha sido modificada en repetidas ocasiones y las disposiciones de importación basadas en el nuevo marco legislativo ya se han introducido en esta Decisión. En aras de la claridad y la transparencia, es conveniente recoger las medidas contempladas en la Decisión 79/542/CEE en un nuevo acto jurídico. El presente Reglamento incluye todas las disposiciones de la Decisión 79/542/CEE. Por tanto, cuando entre en vigor el presente Reglamento, la dicha Decisión dejará de tener efecto y de ser aplicable, en espera de una derogación explícita.
(7) La Directiva 92/65/CEE establece las condiciones zoosanitarias aplicables a los intercambios y las importaciones en la Unión de animales vivos, esperma, óvulos y embriones no sometidos a los requisitos zoosanitarios que figuran en los actos de la Unión específicos contemplados en su anexo F. Conforme a dicha Directiva, estos animales vivos, esperma, óvulos y embriones solo pueden importarse a la Unión desde un tercer país que figure en una lista confeccionada con arreglo al procedimiento que contempla la Directiva. Además, los animales vivos en cuestión deben ir acompañados de un certificado sanitario conforme a un modelo elaborado en consonancia con el procedimiento a que se hace referencia en la Directiva.
(8) La Directiva 96/93/CE del Consejo, de 17 de diciembre de 1996, relativa a la certificación de animales y productos animales [11], establece las normas que deben respetarse en la expedición de los certificados que exige la legislación veterinaria para prevenir una certificación engañosa o fraudulenta. Ha de velarse por que los inspectores o veterinarios oficiales de terceros países apliquen unas normas y principios que sean, como mínimo, equivalentes a los establecidos en esta Directiva. Algunos terceros países, que figuran en la lista del anexo II del presente Reglamento, han ofrecido garantías suficientes sobre la existencia y la aplicación de tales normas y principios. Por tanto, es conveniente autorizar la introducción en la Unión de determinados animales vivos de estos terceros países siempre que no se requieran otro tipo de restricciones por la aparición de una enfermedad concreta.
(9) La Directiva 2002/99/CE establece las normas zoosanitarias que rigen la introducción en la Unión de productos de origen animal o derivados de estos productos destinados al consumo humano. De conformidad con esta Directiva, deben establecerse listas de los terceros países o zonas de los terceros países desde los que está permitida la importación de determinados productos de origen animal, y estos productos han de ajustarse a ciertos requisitos de certificación veterinaria.
(10) La Directiva 2004/68/CE establece los requisitos zoosanitarios para la importación a la Unión de determinados ungulados vivos y su tránsito por esta. Solo se permite la importación o el tránsito de tales ungulados vivos por la Unión si estos proceden de los terceros países o territorios que figuran en la(s) lista(s) elaborada(s) con arreglo al procedimiento contemplado en dicha Directiva; estas importaciones deben asimismo cumplir determinados requisitos de certificación veterinaria.
(11) A excepción de las disposiciones del artículo 17, apartado 2, último párrafo, de la Directiva 92/65/CEE, solo se autoriza la importación a la Unión o el tránsito por ella de los animales vivos y los productos de origen animal a los que se aplican las Directivas 92/65/CEE, 2002/99/CE y 2004/68/CE si van acompañados de un certificado veterinario y cumplen los requisitos pertinentes que establece la legislación de la Unión.
(12) Por tanto, a efectos de aplicar las Directivas 92/65/CEE, 2002/99/CE y 2004/68/CE, procede establecer en el presente Reglamento listas de terceros países, territorios y partes de terceros países o territorios que recojan las condiciones de importación específicas, incluidos los modelos de certificados veterinarios para determinados animales vivos y la carne fresca de ciertos animales.
(13) En aras de la coherencia de la legislación de la Unión, el presente Reglamento debe tener en cuenta asimismo los requisitos sanitarios establecidos en otros actos de la Unión, en particular, en los Reglamentos (CE) nº 852/2004, (CE) nº 853/2004 y (CE) nº 854/2004, que disponen las normas relativas a la higiene de los alimentos y los productos alimenticios de origen animal y las normas concernientes a la organización de los controles oficiales de productos de origen animal destinados al consumo humano, así como los requisitos que recogen la Directiva 96/23/CE del Consejo, de 29 de abril de 1996, relativa a las medidas de control aplicables respecto de determinadas sustancias y sus residuos en los animales vivos y sus productos [12], y el Reglamento (CE) nº 999/2001 del Parlamento Europeo y del Consejo, de 22 de mayo de 2001, por el que se establecen disposiciones para la prevención, el control y la erradicación de determinadas encefalopatías espongiformes transmisibles [13].
(14) El Reglamento (CE) nº 882/2004 establece normas generales para la realización de los controles oficiales en materia de piensos y alimentos y la normativa sobre salud animal y bienestar de los animales. Su artículo 48 autoriza a la Comisión a establecer una lista de terceros países desde los cuales pueden importarse a la Unión productos específicos. En el Reglamento (CE) nº 854/2004 figuran disposiciones específicas para la organización de controles oficiales de productos de origen animal destinados al consumo humano, entre las que se encuentra la elaboración de listas de los terceros países desde los que se permite la importación de productos de origen animal. Estas disposiciones determinan asimismo la posible combinación de dichas listas con otras listas que se elaboren a efectos tanto sanitarios como zoosanitarios.
(15) Por consiguiente, los modelos de certificados que se establecen en los anexos del presente Reglamento deben incluir declaraciones en las que conste el cumplimiento de los requisitos sanitarios contemplados en la Directiva 96/23/CE y los Reglamentos (CE) nº 999/2001, (CE) nº 852/2004, (CE) nº 853/2004 y (CE) nº 854/2004.
(16) Es conveniente asimismo que los modelos de certificados establecidos en los anexos del presente Reglamento incluyan declaraciones en las que conste el cumplimiento de los requisitos de bienestar de los animales contemplados en la Directiva 93/119/CE del Consejo, de 22 de diciembre de 1993, relativa a la protección de los animales en el momento de su sacrificio o matanza [14] y el Reglamento (CE) nº 1/2005 del Consejo, de 22 de diciembre de 2004, relativo a la protección de los animales durante el transporte y las operaciones conexas [15].
(17) A fin de velar por que no se ponga en peligro la salud de animales vivos introducidos en la Unión durante su transporte a la misma desde el tercer país de origen, es conveniente fijar determinadas normas en relación con el transporte de los animales vivos que incluyan disposiciones en torno a los centros de concentración de animales.
(18) Para garantizar la protección de la salud zoosanitaria en la Unión, debe transferirse a los animales vivos directamente a su lugar de destino en la Unión.
(19) La carne fresca introducida en la Unidad en tránsito a otro tercer país plantea un riesgo insignificante de salud pública. No obstante, esta carne debe cumplir todas las disposiciones zoosanitarias pertinentes. Por tanto, procede establecer disposiciones concretas sobre el tránsito y el almacenamiento antes del tránsito, en relación con la carne fresca.
(20) Dada la situación geográfica de Kaliningrado, que solo afecta a Letonia, Lituania y Polonia, deben establecerse condiciones específicas para el tránsito por la Unión de partidas destinadas a Rusia o procedentes de este país.
(21) Debe autorizarse la introducción en la Unión de partidas de carne fresca, a excepción de los despojos y la carne picada, de animales no domésticos criados en explotación del orden de los artiodáctilos, procedentes de animales cazados estando en libertad. Con objeto de descartar cualquier riesgo zoosanitario que plantease la introducción de estos animales, es conveniente separarlos de los animales silvestres en el plazo de los tres meses anteriores a la entrada en la Unión de dichas partidas. Por tanto, el modelo de certificado veterinario correspondiente a estas partidas (modelo RUF) debe tener en cuenta esta cuestión.
(22) La Decisión 2003/881/CE de la Comisión, de 11 de diciembre de 2003, relativa a las condiciones de policía sanitaria y de certificación aplicables a las importaciones de abejas (Apis mellifera y Bombus spp.) procedentes de determinados terceros países [16] establece las condiciones zoosanitarias y de certificación para las importaciones de abejas provenientes de determinados terceros países. En aras de la simplificación de la legislación de la Unión, es conveniente incluir en el presente Reglamento las medidas establecidas en esta Decisión. En consecuencia, procede derogar la Decisión 2003/881/CE.
(23) Conviene introducir un periodo transitorio que permita a los Estados miembros y a la industria adoptar las medidas necesarias para cumplir los nuevos requisitos establecidos en el presente Reglamento.
(24) Las medidas previstas en el presente Reglamento se ajustan al dictamen del Comité Permanente de la Cadena Alimentaria y de Sanidad Animal.
HA ADOPTADO EL PRESENTE REGLAMENTO:
Objeto y ámbito de aplicación
1. El presente Reglamento establece los requisitos de certificación veterinaria para la introducción en la Unión de partidas que contengan los siguientes animales vivos o carne fresca:
a) ungulados;
b) los animales enumerados en el anexo IV, parte 2;
c) la carne fresca de ungulados y équidos destinada al consumo humano, a excepción de los preparados de carne.
2. El presente Reglamento establece las listas de terceros países, territorios o bien partes de terceros países o territorios desde los que pueden introducirse en la Unión las partidas contempladas en el apartado 1.
3. El presente Reglamento no se aplicará a la introducción en la Unión de animales no domésticos:
a) destinados a espectáculos o muestras en las que no se crían habitualmente este tipo de animales vivos;
b) que formen parte de circos;
c) destinados a organismos, institutos o centros autorizados, conforme a la definición del artículo 2, apartado 1, letra c), de la Directiva 92/65/CEE.
4. El presente Reglamento se aplicará sin perjuicio de cualquier otro requisito de certificación específico establecido en otros actos de la Unión o en acuerdos celebrados por la Unión con terceros países.
Definiciones
A efectos del presente Reglamento, se entenderá por:
a) "ungulados", los animales del grupo de los ungulados según la definición del artículo 2, letra d), de la Directiva 2004/68/CE;
b) "carne fresca", la carne fresca según la definición del anexo I, punto 1.10, del Reglamento (CE) nº 853/2004;
c) "équidos", los animales de la familia de los équidos según la definición del artículo 2, letra b), de la Directiva 90/426/CE del Consejo [17];
d) "explotación", toda granja u otra empresa comercial, industrial o agrícola supervisada oficialmente, incluidos los zoológicos, los parques de atracciones, las reservas naturales y los cotos de caza, donde se crían animales habitualmente.
Condiciones generales para la introducción en la Unión de ungulados
Solo se permitirá la introducción en la Unión de ungulados que cumplan las condiciones siguientes:
a) que procedan de los terceros países, territorios, o bien partes de los terceros países o territorios enumerados en las columnas 1, 2 y 3 del cuadro que figura en el anexo I, parte 1, para los que la columna 4 del mismo cuadro prevea un modelo de certificado veterinario correspondiente a la partida de que se trate;
b) que vayan acompañados del certificado veterinario correspondiente, elaborado según el modelo de certificado veterinario pertinente que figura en el anexo I, parte 2, teniendo en cuenta las condiciones específicas indicadas en la columna 6 del cuadro contemplado en la parte 1 del mismo anexo, y que deberá ir cumplimentado y firmado por un veterinario oficial del tercer país exportador;
c) que cumplan los requisitos determinados en el certificado veterinario al que se hace referencia en la letra b), incluido lo siguiente:
i) las garantías adicionales establecidas en dicho certificado, cuando así se indique en la columna 5 del cuadro que figura en el anexo I, parte 1;
ii) cualquier requisito adicional de certificación veterinaria que imponga el Estado miembro de destino, de conformidad con la legislación veterinaria de la Unión, que esté recogido en el certificado.
Condiciones para los centros de concentración de animales destinados a determinadas partidas de ungulados
Las partidas de ungulados vivos procedentes de más de una explotación podrán introducirse en la Unión únicamente si los animales se han agrupado en centros de concentración de animales autorizados por la autoridad competente del tercer país de origen de acuerdo con los requisitos establecidos en el anexo I, parte 5.
Protocolos para la normalización de los materiales y los procedimientos de muestreo y análisis en relación con los ungulados
Cuando los certificados veterinarios que figuran en la columna 4 del cuadro del anexo I, parte 1, requieran muestreo y análisis en relación con las enfermedades contempladas en la parte 6 del anexo, la introducción en la Unión de partidas de ungulados estará sujeta a que la autoridad competente del tercer país de origen se responsabilice de la toma de muestras y la realización de pruebas de laboratorio, de conformidad con los protocolos para la normalización de materiales y los procedimientos de análisis determinados en dicha parte 6, o de controlar que estos se lleven a cabo.
Condiciones especiales para determinadas partidas de ungulados importadas a San Pedro y Miquelón e introducidas a la Unión
Las partidas de ungulados de las especies enumeradas en el cuadro del anexo I, parte 7, introducidas en San Pedro y Miquelón en un plazo inferior a seis meses antes de la fecha de envío desde San Pedro y Miquelón hasta la Unión, solo podrán entrar en la Unión si:
a) cumplen con los requisitos de residencia y cuarentena fijados en el capítulo I de esta parte;
b) han sido sometidos a pruebas de acuerdo con los requisitos de pruebas zoosanitarias que se recogen en el capítulo II de esta parte.
Condiciones generales para la introducción de determinadas especies de abejas en la Unión
1. Solo podrán introducirse en la Unión las partidas de abejas de las especies enumeradas en el cuadro 1 del anexo IV, parte 2, procedentes de los terceros países o territorios:
a) enumerados en el anexo II, parte 1;
b) en la totalidad de cuyo territorio sea preceptivo notificar la presencia de la loque americana, el pequeño escarabajo de la colmena (Aethina tumida) y el ácaro Troipilaelpas mite (Tropilaelaps spp.).
2. No obstante lo dispuesto en el apartado 1, letra a), estará permitida la introducción en la Unión de partidas de abejas procedentes de una parte de un tercer país o territorio enumerado en el anexo II, parte 1, que:
a) sea una parte de un tercer país o territorio geográfica y epidemiológicamente aislada;
b) figure en la tercera columna del cuadro del anexo IV, parte 1, sección 1.
Cuando se aplique esta excepción, se prohibirá la introducción en la Unión de partidas de abejas procedentes de todas las demás partes del tercer país o territorio afectado que no figuren en la tercera columna del cuadro situado en el anexo IV, parte 1, sección 1.
3. Las partidas de abejas de las especies enumeradas en el cuadro 1 del anexo IV, parte 2, estarán compuestas de:
a) jaulas de abejas reina (Apis mellifera y Bombus spp.), cada una de ellas con una sola abeja reina y un máximo de veinte acompañantes; o
b) contenedores de abejorros (Bombus spp.), cada uno de ellos con una colonia compuesta por un máximo de doscientos abejorros adultos.
4. Las partidas de abejas de las especies enumeradas en el cuadro 1 del anexo IV, parte 2, deberán:
a) ir acompañadas del certificado veterinario correspondiente, que habrá de ajustarse al modelo de certificado veterinario pertinente que se establece en el anexo IV, parte 2, y que deberá ir firmado y cumplimentado por un inspector oficial del tercer país exportador;
b) cumplir los requisitos determinados en el certificado veterinario al que se hace referencia en la letra a).
Condiciones generales relativas al transporte de animales vivos destinados a la Unión
Durante el periodo que medie entre la carga de los animales en el tercer país de origen y su llegada al puesto de inspección fronterizo para su entrada en la Unión, las partidas de animales vivos no deberán:
a) transportarse junto con animales vivos que
i) no estén destinados a la Unión; o
ii) tengan una calificación sanitaria inferior;
b) descargarse o bien trasladarse a otro avión — en el caso del transporte aéreo —, transportarse por carretera, por ferrocarril o a pie a través de terceros países, territorios o parte de los mismos que no estén enumerados en las columnas 1, 2 y 3 del cuadro que figura en el anexo I, parte 1, o para las que no exista un modelo de certificado veterinario correspondiente a la partida en cuestión en la columna 4 del mismo cuadro.
Plazos para el transporte de animales vivos a la Unión
Solo podrán introducirse en la Unión partidas de animales vivos que lleguen al puesto de inspección fronterizo para su entrada en la Unión en el plazo de los diez días siguientes a la fecha de expedición del certificado veterinario correspondiente.
En el caso del transporte marítimo, se ampliará este plazo de diez días mediante la adición de un periodo adicional correspondiente a la duración de la jornada por mar, que deberá certificarse mediante declaración firmada del capitán del buque, elaborada conforme al anexo I, parte 3, cuyo original deberá adjuntarse al certificado veterinario.
Condiciones especiales con respecto a la fumigación de partidas de animales vivos transportadas a la Unión por vía aérea
Cuando se transporten por vía aérea partidas de animales vivos, a excepción de las partidas de abejas, se fumigarán la jaula o el contenedor en que sean transportadas y la zona adyacente con un insecticida apropiado.
La fumigación tendrá lugar inmediatamente antes de cerrarse las compuertas del aparato y cada vez que deban abrirse las compuertas en un tercer país, antes de llegar al destino final.
El comandante del avión certificará la fumigación mediante declaración firmada, elaborada conforme al anexo I, parte 4, cuyo original deberá adjuntarse al certificado veterinario.
Condiciones que deben respetarse tras la introducción en la Unión de determinadas partidas de ungulados
1. Una vez introducidas en la Unión, las partidas de ungulados destinadas a la cría y producción o que deben enviarse a zoos, parques de atracciones, reservas naturales o cotos de caza, se remitirán sin dilación a la explotación de destino.
Los ungulados permanecerán en dicha explotación durante un mínimo de treinta días salvo que se envíen directamente a un matadero.
2. Las partidas de ungulados destinadas al sacrificio inmediato, una vez introducidas en la Unión, se remitirán sin dilación al matadero de destino, en el que deberán sacrificarse en el plazo de los cinco días laborables siguientes a la fecha de su llegada al mismo.
Condiciones específicas en lo referente al tránsito de determinadas partidas de ungulados a través de terceros países
Cuando se aplique la condición específica I del anexo I, parte 1, a fin de permitir que las partidas de ungulados contempladas en esta condición, que proceden de un Estado miembro y están destinadas a otro Estado miembro, transiten a través de un tercer país, territorio o bien parte de tercer país o territorio enumerado en el cuadro del anexo I, parte 1, sin que figure un modelo de certificado veterinario correspondiente a estas partidas de ungulados en la columna 4 del cuadro, serán de aplicación las condiciones siguientes:
a) en el caso de los bovinos de engorde:
i) la autoridad del lugar de destino definitivo deberá designar con antelación las explotaciones de destino definitivas;
ii) los animales vivos que componen la partida no deberán moverse de la explotación de destino definitivo salvo para ser sacrificados directamente;
iii) todos los desplazamientos de los animales vivos de entrada o salida a la explotación de destino definitivo deberán llevarse a cabo bajo el control de la autoridad competente mientras los animales que componen la partida se críen en la explotación;
b) en el caso de los ungulados destinados al sacrificio inmediato, se aplicará el artículo 11, apartado 2.
Condiciones que deben aplicarse tras la introducción en la Unión de las partidas de abejas contempladas en el artículo 7
1. Las partidas de abejas reina contempladas en el artículo 7, apartado 3, letra a), se trasladarán sin demora al lugar designado de destino definitivo, donde las colmenas se pondrán bajo control de la autoridad competente y las abejas reinas se transferirán a jaulas nuevas antes de ser introducidas en colonias locales.
2. Se enviarán las jaulas, los acompañantes y cualquier otro material que haya llegado con las abejas reina del tercer país de origen a un laboratorio designado por la autoridad competente para determinar:
a) la presencia del pequeño escarabajo de la colmena (Aethina tumida), sus huevos o larvas;
b) cualquier signo del ácaro Tropilaelaps mite (Tropilaelaps spp.).
Tras este examen de laboratorio, se eliminarán las jaulas, los acompañantes y el citado material.
3. Las partidas de abejorros (Bombus spp.) contempladas en el artículo 7, apartado 3, letra b), se trasladarán sin demora al lugar designado de destino.
Estos abejorros podrán permanecer en el contenedor en el que viajaron a la Unión hasta que finalice el ciclo vital de la colonia.
El contenedor y el material que haya acompañado a los abejorros desde su tercer país de origen se eliminará, a más tardar, al final del ciclo vital de la colonia.
Condiciones generales para la importación de carne fresca
Solo se permitirá la introducción en la Unión de partidas de carne fresca destinada al consumo humano que cumplan las condiciones siguientes:
a) que procedan de los terceros países, territorios, o bien partes de los terceros países o territorios enumerados en las columnas 1, 2 y 3 del cuadro que figura en el anexo II, parte 1, para los que la columna 4 del mismo cuadro prevea un modelo de certificado veterinario correspondiente a la partida de que se trate;
b) que se presenten en el puesto de inspección fronterizo de entrada en la Unión acompañadas del certificado veterinario correspondiente, que deberá ajustarse al modelo de certificado veterinario pertinente que figura en el anexo II, parte 2, teniendo en cuenta las condiciones específicas indicadas en la columna 6 del cuadro contemplado en la parte 1 del mismo anexo, y que deberá ir cumplimentado y firmado por un veterinario oficial del tercer país exportador;
c) que cumplan los requisitos determinados en el certificado veterinario al que se hace referencia en la letra b), incluido lo siguiente:
i) las garantías adicionales determinadas en dicho certificado, cuando así se indique en la columna 5 del cuadro que figura en el anexo II, parte 1;
ii) cualquier requisito adicional de certificación veterinaria que imponga el Estado miembro de destino, de conformidad con la legislación veterinaria de la Unión, que esté recogido en el certificado.
Condiciones que deben aplicarse tras la importación de canales sin desollar de biungulados de caza silvestres
De conformidad con el artículo 8, apartado 2, de la Directiva 97/78/CE del Consejo [18], las partidas de canales sin desollar de biungulados de caza silvestres que serán aptas para el consumo humano una vez sometidas a transformación se enviarán sin demora al establecimiento de transformación al que vayan destinadas.
Tránsito y almacenamiento de carne fresca
Solo se permitirá la introducción en la Unión de partidas de carne fresca destinadas a un tercer país, que únicamente se almacenen de forma provisional o se encuentren en tránsito en la Unión de conformidad con lo dispuesto en el artículo 12, apartado 4, y el artículo 13 de la Directiva 97/78/CE, si las partidas cumplen las condiciones siguientes:
a) que procedan de los terceros países, territorios, o bien partes de los terceros países o territorios enumerados en las columnas 1, 2 y 3 del cuadro que figura en el anexo II, parte 1, para los que la columna 4 del mismo cuadro prevea un modelo de certificado veterinario que corresponda a las partidas en cuestión;
b) que cumplan los requisitos zoosanitarios específicos para la partida en cuestión, conforme a lo dispuesto en el modelo de certificado veterinario pertinente contemplado en la letra a);
c) que vayan acompañadas de un certificado veterinario, que deberá ajustarse al modelo de certificado veterinario establecido en el anexo III e ir firmado y cumplimentado por un veterinario oficial del tercer país exportador;
d) que estén certificadas como aptas para el tránsito, incluido el almacenamiento, en su caso, mediante el Documento Veterinario Común de Entrada contemplado en el artículo 2, apartado 1, del Reglamento (CE) nº 136/2004 de la Comisión [19], firmado por el veterinario oficial del puesto de inspección fronterizo de entrada en la Unión.
Excepción para el tránsito por Letonia, Lituania y Polonia
1. No obstante lo dispuesto en el artículo 16, se permitirá el tránsito por carretera o ferrocarril a través de la Unión entre los puestos de inspección fronterizos designados de Letonia, Lituania y Polonia que se contemplan en la Decisión 2009/821/CE de la Comisión [20], de las partidas cuyo país de origen o destino sea Rusia, ya sea directamente o a través de otro tercer país, siempre que se cumplan las condiciones siguientes:
a) que las partidas hayan sido precintadas en el puesto de inspección fronterizo de entrada en la Unión por los servicios veterinarios de la autoridad competente, con un sello que deberá llevar un número de serie;
b) que los documentos que acompañen a las partidas, contemplados en el artículo 7 de la Directiva 97/78/CE, lleven en cada página un sello con la inscripción "SOLO PARA TRÁNSITO POR LA UE CON DESTINO A RUSIA", estampado por el veterinario oficial de la autoridad competente responsable del puesto de inspección fronterizo de entrada en la Unión;
c) que se cumplan los requisitos procedimentales contemplados en el artículo 11 de la Directiva 97/78/CE;
d) que las partidas hayan sido certificadas como aptas para el tránsito en el Documento Veterinario Común de Entrada expedido por el veterinario oficial del puesto de inspección fronterizo de entrada en la Unión.
2. No se permitirá la descarga o el almacenamiento a tenor de lo dispuesto en el artículo 12, apartado 4, o en el artículo 13 de la Directiva 97/78/CE de dichas partidas en el territorio de la Unión.
3. La autoridad competente realizará periódicamente auditorías para verificar que el número de partidas y las cantidades de los productos que salen del territorio de la Unión corresponden al número y las cantidades introducidas en el mismo.
Certificación
Los certificados veterinarios que exige el presente Reglamento se cumplimentarán de conformidad con las notas explicativas del anexo V.
No obstante, esta disposición no excluirá la utilización de certificación electrónica u otros sistemas autorizados y armonizados a nivel de la Unión.
Durante un periodo transitorio que se extenderá hasta el 30 de junio de 2010, se permitirá la introducción en la Unión de partidas de animales vivos y carne fresca destinada al consumo humano en relación con las cuales se hayan expedido los certificados veterinarios pertinentes con arreglo a las Decisiones 79/542/CEE o 2003/881/CE.
Derogación
Queda derogada la Decisión 2003/881/CE.
Entrada en vigor
El presente Reglamento entrará en vigor el vigésimo día siguiente al de su publicación en el Diario Oficial de la Unión Europea.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, 16 de marzo de 2010.
Por la Comisión
José Manuel Barroso
Presidente
(1) DO L 268 de 14.9.1992, p. 54.
(2) DO L 18 de 23.1.2003, p. 11.
(3) DO L 139 de 30.4.2004, p. 321.
(4) DO L 139 de 30.4.2004, p. 1.
(5) DO L 139 de 30.4.2004, p. 55.
(6) DO L 139 de 30.4.2004, p. 206.
(7) DO L 165 de 30.4.2004, p. 1.
(8) DO L 302 de 31.12.1972, p. 28.
(9) DO L 146 de 14.6.1979, p. 15.
(10) DO L 157 de 30.4.2004, p. 33.
(11) DO L 13 de 16.1.1997, p. 28.
(12) DO L 125 de 23.5.1996, p. 10.
(13) DO L 147 de 31.5.2001, p. 1.
(14) DO L 340 de 31.12.1993, p. 21.
(15) DO L 3 de 5.1.2005, p. 1.
(16) DO L 328 de 17.12.2003, p. 26.
(17) DO L 224 de 18.8.1990, p. 42.
(18) DO L 24 de 30.1.1998, p. 9.
(19) DO L 21 de 28.1.2004, p. 11.
(20) DO L 296 de 12.11.2009, p. 1..
PARTE 1
Lista de terceros países, territorios o bien partes de terceros países o territorios [*]
TABLA OMITIDA EN PÁGINA 9
Condiciones específicas (véanse las notas a pie de página de cada certificado)
"I": para el paso por el territorio de un tercer país de animales vivos destinados al sacrificio inmediato o de bovinos de engorde, procedentes de un Estado miembro y con destino a otro Estado miembro, en camiones precintados con un sello que llevará un número de serie.
El número de sello deberá indicarse en el certificado sanitario expedido conforme al modelo que se establece en el anexo F de la Directiva 64/432/CEE [6], sobre bovinos vivos para engorde o sacrificio, y en el certificado sanitario conforme al modelo I del anexo E de la Directiva 91/68/CEE [7], sobre ovinos y caprinos destinados al sacrificio.
Además, el sello deberá estar intacto a su llegada al puesto de inspección fronterizo de entrada en la Unión designado y registrarse en Traces (sistema informático integrado de la Unión en el ámbito veterinario).
La autoridad veterinaria competente sellará el certificado en el punto de salida de la Unión antes del paso a uno o más terceros países con la siguiente indicación: "SOLO PARA EL PASO ENTRE DIVERSAS PARTES DE LA UNIÓN EUROPEA A TRAVÉS DE LA ANTIGUA REPÚBLICA YUGOSLAVA DE MACEDONIA / MONTENEGRO / SERBIA [] []".
Los bovinos de engorde deberán transportarse directamente a la explotación de destino designada por la autoridad veterinaria competente del lugar de destino. Estos animales deberán permanecer en dicha explotación salvo para ser enviados inmediatamente al sacrificio.
"II": territorio reconocido oficialmente indemne de tuberculosis a efectos de exportación a la Unión de animales vivos certificados de conformidad con el modelo de certificado BOV-X.
"III": territorio reconocido oficialmente indemne de brucelosis a efectos de exportación a la Unión de animales vivos certificados de conformidad con el modelo de certificado BOV-X.
"IVa": territorio reconocido oficialmente indemne de leucosis bovina enzoótica a efectos de exportación a la Unión de animales vivos certificados de conformidad con el modelo de certificado BOV-X.
"IVb": territorio con explotaciones autorizadas reconocidas oficialmente indemnes de leucosis bovina enzoótica a efectos de exportación a la Unión de animales vivos certificados de conformidad con el modelo de certificado BOV-X.
"V": territorio reconocido oficialmente indemne de brucelosis a efectos de exportación a la Unión de animales vivos certificados de conformidad con el modelo de certificado OVI-X.
"VI": restricciones geográficas.
"VII": territorio reconocido oficialmente indemne de tuberculosis a efectos de exportación a la Unión de animales vivos certificados de conformidad con el modelo de certificado RUM.
"VIII": territorio reconocido oficialmente indemne de brucelosis a efectos de exportación a la Unión de animales vivos certificados de conformidad con el modelo de certificado RUM.
"IX" : territorio reconocido oficialmente indemne de la enfermedad de Aujeszky a efectos de exportación a la Unión de animales vivos certificados de conformidad con el modelo de certificado POR-X.
PARTE 2
Modelos de certificados veterinarios
Modelos:
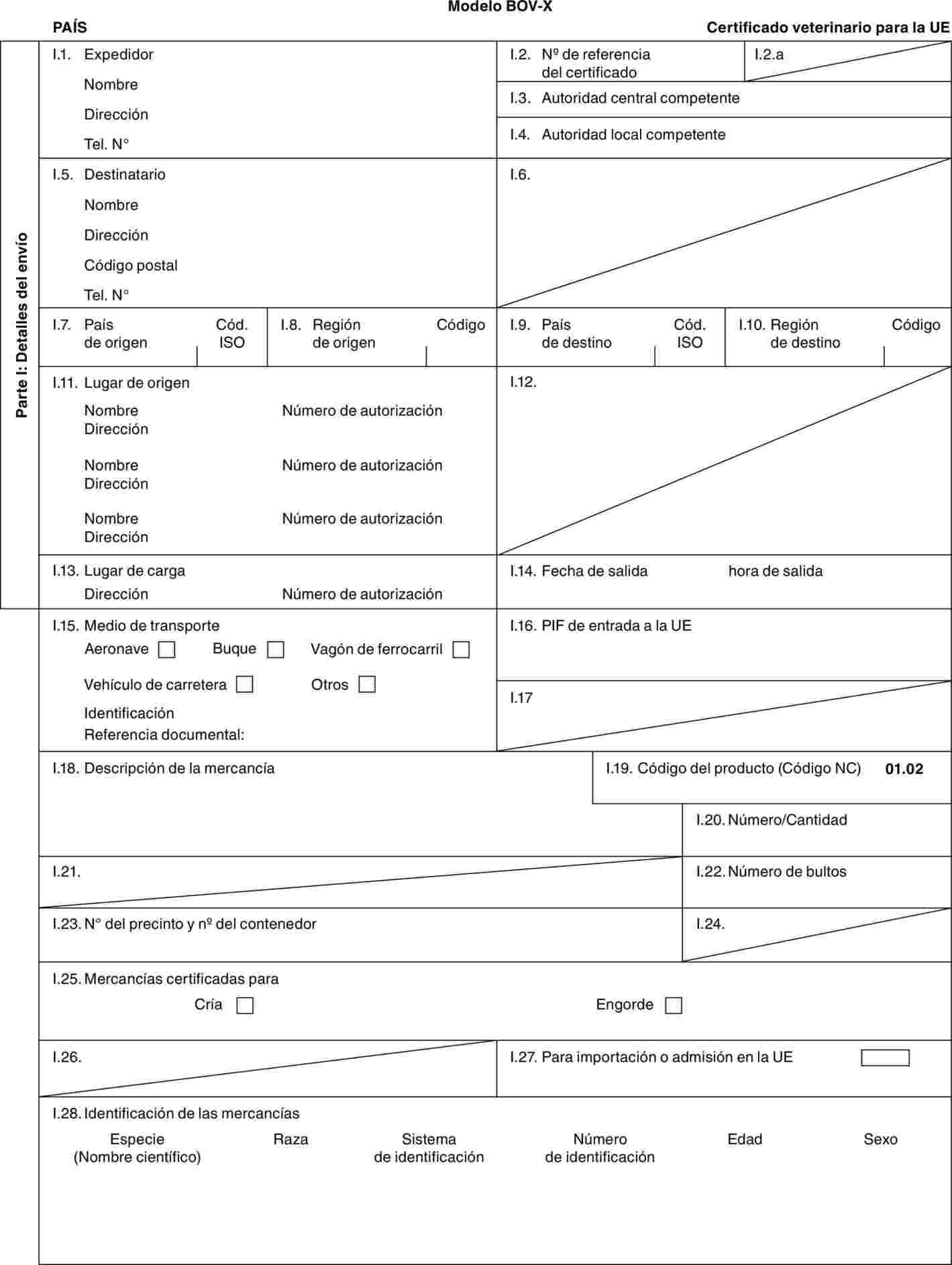
"BOV-X": modelo de certificado veterinario para ganado bovino doméstico (incluidas las especies de los géneros Bubalus y Bison y sus cruces), destinado a la cría o a la producción tras la importación.
"BOV-Y": modelo de certificado veterinario para ganado bovino doméstico (incluidas las especies de los géneros Bubalus y Bison y sus cruces), destinado al sacrificio inmediato tras la importación.
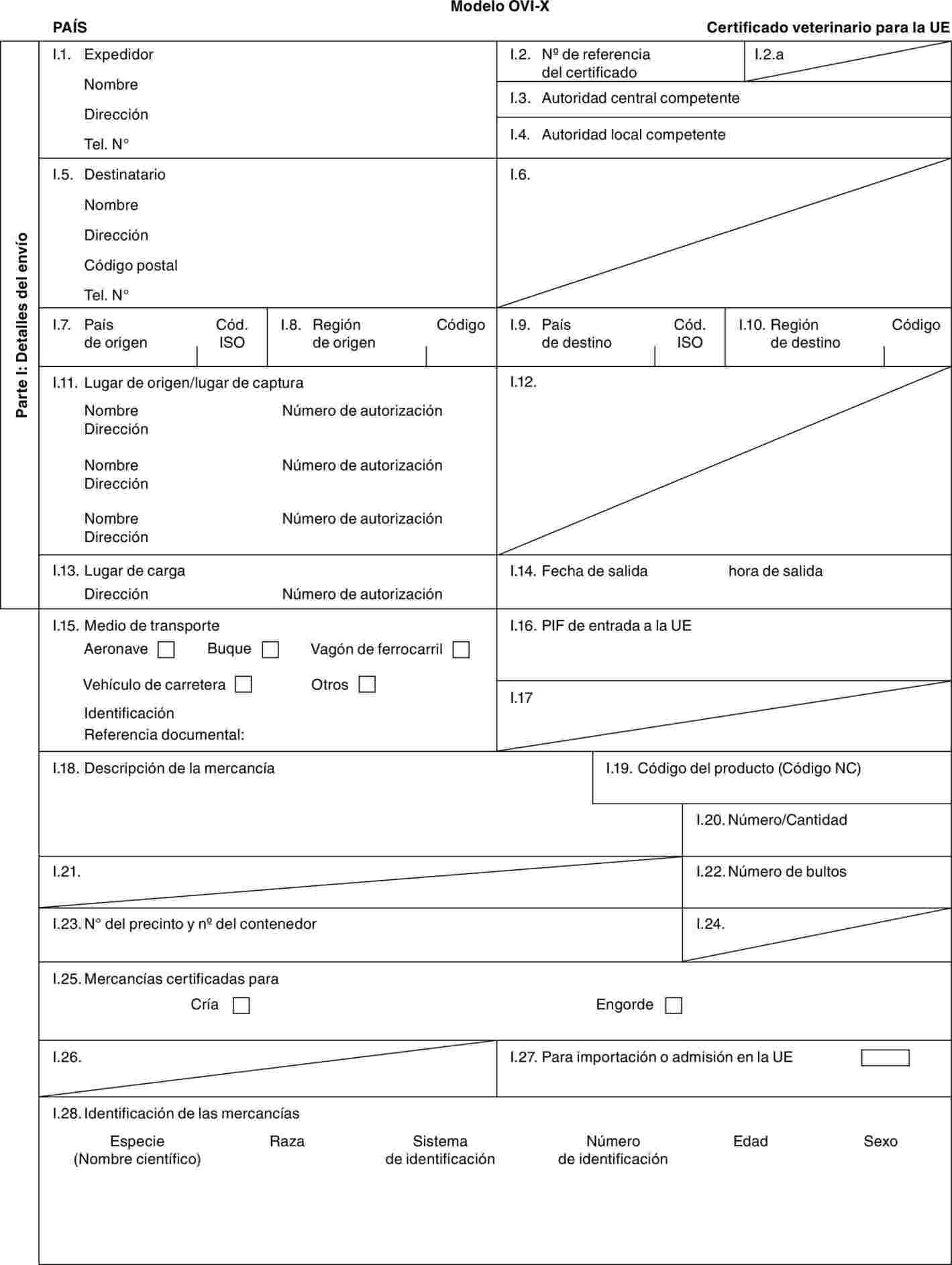
"OVI-X": modelo de certificado veterinario para ganado ovino (Ovis aries) y caprino (Capra hircus) doméstico destinado a la cría o a la producción tras la importación.
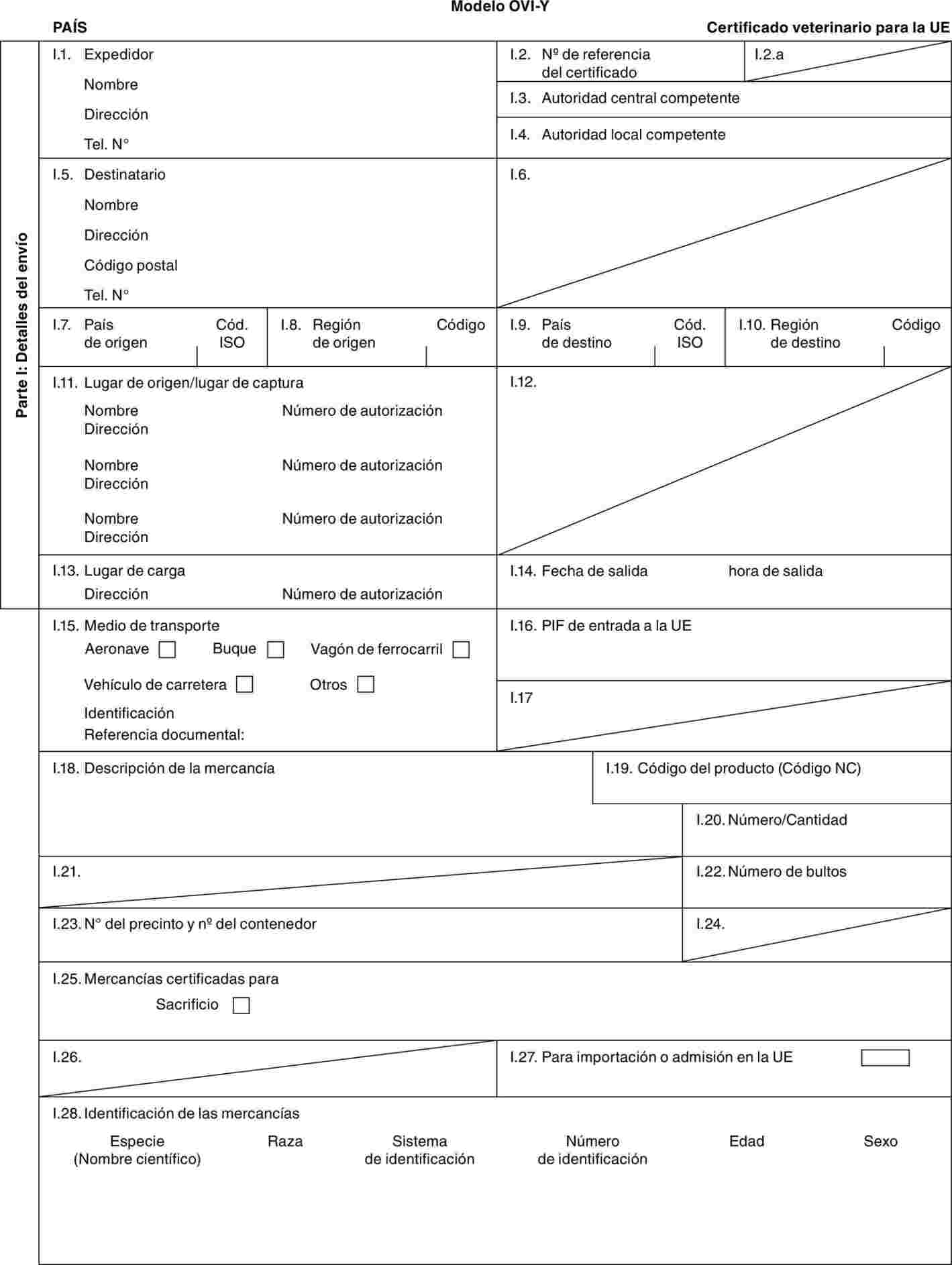
"OVI-Y": modelo de certificado veterinario para ganado ovino (Ovis aries) y caprino (Capra hircus) doméstico destinado al sacrificio inmediato tras la importación.
"POR-X": modelo de certificado veterinario para ganado porcino doméstico (Sus scrofa) destinado a la cría o a la producción tras la importación.
"POR-Y": modelo de certificado veterinario para ganado porcino doméstico (Sus scrofa) destinado al sacrificio inmediato tras la importación.
"RUM": modelo de certificado veterinario para animales del orden de los artiodáctilos (excluidos los bovinos —también las especies de los géneros Bubalus y Bison y sus cruces—, Ovis aries, Capra hircus, los suidos y tayasuidos), y de las familias de los rinoceróntidos y elefántidos.
"SUI": modelo de certificado veterinario para suidos, tayasuidos y tapíridos no domésticos.
"CAM": modelo de certificado específico para los animales importados de San Pedro y Miquelón en las condiciones estipuladas en el anexo I, parte 7.
GA (Garantías adicionales):
"A": garantías relativas a las pruebas de detección de la fiebre catarral ovina (lengua azul) y de la enfermedad hemorrágica epizoótica en animales certificados de conformidad con los modelos de certificados BOV-X (punto II.2.8.B), OVI-X (punto II.2.6.D) y RUM (punto II.2.6).
"B": garantías relativas a las pruebas de detección de la enfermedad vesicular porcina y de la peste porcina clásica en animales certificados de conformidad con los modelos de certificados POR-X (punto II.2.4.B) y SUI (punto II.2.4.B).
"C": garantías relativas a las pruebas de detección de la brucelosis en animales certificados de conformidad con los modelos de certificados POR-X (punto II.2.4.C) y SUI (punto II.2.4.C).
Modelo BOV-X





































PARTE 3
Apéndice relativo al transporte marítimo de animales
(Deberá cumplimentarse y adjuntarse al certificado veterinario cuando el transporte hasta la frontera de la Unión comprenda, aunque sea solo parcialmente, el transporte por barco)
|
Declaración del patrón del barco |
|
|
El abajo firmante, capitán del buque (nombre …), declara que los animales a que se hace referencia en el certificado veterinario adjunto no … han permanecido a bordo del buque durante el viaje desde … en … (país exportador) hasta … en la Unión y que el buque no ha hecho escalas en ningún lugar fuera de … (país exportador) en ruta hacia la Unión, salvo en … (puertos de escala en ruta). Además, durante el viaje los animales no han estado en contacto con otros animales a bordo que tuvieran una calificación sanitaria inferior. Hecho en …, el … |
|
|
(Puerto de arribada) |
(Fecha de arribada) |
|
(Sello) |
(Firma del capitán) |
|
(Nombre y apellidos en letras mayúsculas y cargo) |
PARTE 4
Apéndice relativo al transporte aéreo de animales
(Deberá cumplimentarse y adjuntarse al certificado veterinario cuando el transporte hasta la frontera de la Unión comprenda, aunque sea solo parcialmente, el transporte aéreo)
|
Declaración del comandante del avión |
|
|
El abajo firmante, comandante del avión (nombre …), declara que el cajón o jaula en que se encuentran los animales a que se hace referencia en el certificado veterinario adjunto no … y la zona adyacente han sido fumigados con un insecticida antes de la salida del vuelo. Hecho en …, el … |
|
|
(Aeropuerto de salida) |
(Fecha de salida) |
|
(Sello) |
(Firma del comandante de vuelo) |
|
(Nombre y apellidos en letras mayúsculas y cargo) |
PARTE 5
Condiciones para la autorización de los centros de concentración de animales (contemplados en el artículo 4)
Para ser autorizados, los centros de concentración de animales deben cumplir los requisitos siguientes:
I. Estar supervisados por un veterinario oficial.
II. Estar situados en el centro de una zona de 20 km de diámetro en la que, según los datos oficiales, no se haya registrado ningún caso de fiebre aftosa como mínimo durante los treinta días anteriores a su utilización como centros autorizados.
III. Previamente a su utilización como centros de concentración autorizados, haber sido limpiados y desinfectados con un desinfectante oficialmente autorizado en el país exportador por ser eficaz en la lucha contra la fiebre aftosa.
IV. Disponer, en función de su capacidad de alojamiento de animales, de lo siguiente:
a) una nave de uso exclusivo como centro de concentración;
b) unas instalaciones adecuadas, fáciles de limpiar y desinfectar, destinadas a la carga, la descarga y un alojamiento de calidad apropiado para los animales, que permitan suministrarles agua y alimentos, y dispensarles cualquier tratamiento necesario;
c) unas salas de inspección y aislamiento adecuadas;
d) un equipo adecuado para la limpieza y desinfección de dependencias y camiones;
e) una zona apropiada para el almacenamiento de piensos, yacija y estiércol;
f) un sistema adecuado de recogida y eliminación de aguas residuales;
g) un despacho para el veterinario oficial.
V. Disponer, cuando esté en funcionamiento, de suficientes veterinarios para efectuar todas las tareas especificadas en la parte 5.
VI. Admitir solo animales que estén identificados individualmente, con el fin de garantizar la trazabilidad. A este efecto, el propietario o encargado del centro deberá asegurarse de que los animales admitidos estén identificados adecuadamente y vayan acompañados de los documentos o los certificados sanitarios pertinentes para cada especie y categoría.
Además, el propietario o encargado del centro deberá dejar constancia en un registro o base de datos, durante un mínimo de tres años, del nombre del propietario y el origen de los animales, las fechas de entrada y salida, el número de identificación de los animales o el de registro de la manada de origen, la explotación de destino, el número de registro del transportista y el del camión que haya transportado los animales al centro o los haya recogido del mismo.
VII. Todos los animales que pasen por un centro de concentración deberán cumplir las condiciones sanitarias establecidas para la introducción de la categoría correspondiente de animales en la Unión.
VIII. Los animales destinados a la Unión que pasen por un centro de concentración deberán cargarse y enviarse directamente a la frontera del país exportador en el plazo de los seis días siguientes a su llegada al centro:
a) sin haber entrado en contacto con biungulados que no cumplan las normas veterinarias establecidas para la introducción de la correspondiente categoría de animales en la Unión;
b) agrupados de tal forma que en un mismo envío no haya animales destinados a la cría o a la producción y animales para el sacrificio inmediato;
c) en vehículos o contenedores previamente limpiados y desinfectados con un desinfectante autorizado oficialmente en el país exportador por ser eficaz en la lucha contra la fiebre aftosa, y construidos de tal forma que durante el transporte no puedan salirse heces, orina, yacija ni pienso.
IX. Cuando una de las condiciones para la exportación de animales a la Unión sea la realización de pruebas en un plazo especificado antes de la carga de los animales, dicho plazo incluirá el eventual periodo de estancia máxima de seis días en un centro de concentración autorizado a contar desde la llegada de los animales al centro.
X. El tercer país exportador designará los centros autorizados para animales de cría y producción o para el sacrificio inmediato, y comunicará a la Comisión y a las autoridades centrales competentes de los Estados miembros los nombres y direcciones de dichos centros. Esta información se actualizará regularmente.
XI. El tercer país exportador determinará el procedimiento para la supervisión oficial de los centros autorizados y se ocupará de que esta se lleve a cabo.
XII. La autoridad competente del tercer país deberá inspeccionar periódicamente los centros de concentración de animales autorizados para verificar que se siguen cumpliendo los criterios de autorización establecidos en los puntos I a XI.
Si las inspecciones detectaran un incumplimiento de las normas, deberá suspenderse la autorización del centro. En tal caso, solo podrá restituirse la autorización cuando la autoridad competente del tercer país considere que el centro vuelve a ajustarse plenamente a los criterios de autorización establecidos en los puntos I a XI.
PARTE 6
Protocolos para la normalización de materiales y procedimientos de análisis
(contemplados en el artículo 5)
Tuberculosis (TBL)
La intradermotuberculinización simple con tuberculina bovina deberá efectuarse de conformidad con el anexo B de la Directiva 64/432/CEE. En el caso de los suidos, la intradermotuberculinización simple con tuberculina aviar se efectuará con arreglo al anexo B de la Directiva 64/432/CEE, con la excepción de que el punto de inyección se situará en la piel flácida de la base de la oreja.
Brucelosis (Brucella abortus) (BRL)
Las pruebas de seroaglutinación, de fijación del complemento, del antígeno brucelar tamponado y de inmunoabsorción enzimática (ELISA) deberán efectuarse de conformidad con las disposiciones del anexo C de la Directiva 64/432/CEE.
Brucelosis (Brucella melitensis) (BRL)
Las pruebas se realizarán de conformidad con las disposiciones del anexo C de la Directiva 91/68/CEE.
Leucosis bovina enzoótica (LBE)
Las pruebas de inmunodifusión en gel de agar y de inmunoabsorción enzimática (ELISA) deberán efectuarse de conformidad con el anexo D, capítulo II, secciones A y C, de la Directiva 64/432/CEE.
Fiebre catarral ovina (FCO)
A) La prueba ELISA competitiva o de bloqueo deberá llevarse a cabo de conformidad con el protocolo siguiente:
La prueba ELISA competitiva que utiliza el anticuerpo monoclonal 3-17-A3 permite identificar los anticuerpos de todos los serotipos conocidos del virus de la FCO.
La prueba se basa en la interrupción de la reacción entre el antígeno del virus de la FCO y un anticuerpo monoclonal específico de grupo (3-17-A3) mediante la adición del suero para análisis. Los anticuerpos del virus de la FCO que se encuentran en el suero para análisis bloquean la reactividad del anticuerpo monoclonal (AM) y producen una reducción de la coloración prevista al añadir el anticuerpo anti-ratón marcado con enzima y el sustrato/cromógeno. Los sueros pueden analizarse empleando una dilución única de 1/5 (prueba de dilución única, véase el apéndice 1) o pueden titularse (titulación serológica, véase el apéndice 2) para que se obtenga la dilución máxima. Los valores de inhibición superiores al 50 % se consideran positivos.
Materiales y reactivos:
1. Placas de microtitulación ELISA apropiadas.
2. Antígeno: suministrado como concentrado de extracto de células, preparado como se describe a continuación y almacenado a –20 °C o –70 °C.
3. Solución amortiguadora de bloqueo: solución salina amortiguadora de fosfatos (SAF) con un 0,3 % de suero de bovino adulto de resultado negativo frente al virus de la FCO y un 0,1 % (v/v) de Tween-20 (en forma de jarabe de monolaurato de polioxietilensorbitol) en SAF.
4. Anticuerpo monoclonal: 3-17-A3 (en forma de sobrenadante de cultivo tisular de hibridomas) dirigido contra el polipéptido vp7 específico de grupo y conservado a –20 °C o liofilizado, diluido antes del uso al 1/100 con solución amortiguadora de bloqueo.
5. Conjugado: globulina de conejo anti-ratón (previamente sometida a adsorción y elución) conjugada con peroxidasa de rábano y conservada al abrigo de la luz a 4 °C.
6. Sustrato y cromógeno: orto-fenilendiamina (cromógeno OFD) a una concentración final de 0,4 mg/ml en agua destilada estéril. Peróxido de hidrógeno (30 % p/v sustrato), 0,05 % v/v añadido inmediatamente antes del uso (5 µl H2 O2 / 10 ml OFD). (Manejar la OFD con cuidado - usar guantes de goma - posible mutágeno).
7. Ácido sulfúrico 1 M: 26,6 ml de ácido añadido a 473,4 ml de agua destilada. (Atención: añadir siempre el ácido al agua, nunca el agua al ácido.)
8. Agitador orbital.
9. Lector de placas ELISA (la prueba puede leerse visualmente).
Formato de la prueba
Cc: control del conjugado (sin suero/sin anticuerpo monoclonal); C++: suero de control marcadamente positivo. C+: suero de control moderadamente positivo. C-: suero de control negativo. Cm: control del anticuerpo monoclonal (sin suero).
APÉNDICE 1
Formato para la prueba de dilución única (1/5) (40 sueros por placa)
TABLA OMITIDA EN PÁGINA 55
APÉNDICE 2
Formato para la titulación del suero (10 sueros por placa)
TABLA OMITIDA EN PÁGINA 55
Protocolo de las pruebas:
Control del conjugado (Cc) : los pocillos 1A y 1B corresponden a un ensayo en blanco, formado por el antígeno del virus de la FCO y el conjugado. Puede utilizarse para ajustar a cero el lector ELISA.
Control del AM (Cm) : las columnas 1 y 2 de las hileras G y H corresponden al control del anticuerpo monoclonal (AM), formado por antígeno del virus de la FCO, el anticuerpo monoclonal y el conjugado. Estos pocillos representan el color máximo. La media de las lecturas de densidad óptica de este control representa el porcentaje nulo de inhibición.
Control positivo (C++ y C+) : columnas 1 y 2 de las hileras C, D, E y F. Estos pocillos contienen antígeno del virus de la FCO, antisuero positivo marcado y moderado respectivamente, AM y conjugado.
Control negativo (C-) : los pocillos 2A y 2B son los controles negativos, que contienen antígeno del virus de la FCO, antisuero de resultado negativo frente al virus de la FCO, AM y conjugado.
Sueros para análisis : en estudios serológicos a gran escala para cribado rápido, los sueros pueden analizarse por dilución única de 1/5 (véase el apéndice 1). Otra posibilidad es analizar 10 sueros en una gama de dilución del 1/5 al 1/640 (véase el apéndice 2). De este modo puede conocerse de forma aproximada el título del anticuerpo en los sueros para análisis.
Procedimiento:
1. Diluir el antígeno del virus de la FCO en una SAF hasta una concentración titulada previamente, tratar brevemente con ultrasonidos para dispersar el virus agregado (si no se dispone de baño de ultrasonidos, pipetear enérgicamente) y añadir 50 µl a todos los pocillos de la placa ELISA. Golpear los lados de la placa para dispersar el antígeno.
2. Incubar a 37 °C durante 60 minutos en un agitador orbital. Lavar las placas tres veces, llenando los pocillos de una SAF no estéril, vaciándolos y secándolos a continuación con papel secante.
3. Pocillos de control: añadir 100 µl de solución amortiguadora de bloqueo a los pocillos de control del conjugado. Añadir 50 µl de sueros de control positivo y negativo, a una dilución de 1/5 (10 µl de suero +40 µl de solución amortiguadora de bloqueo), a los pocillos C-, C+ y C++ correspondientes. Añadir 50 µl de solución amortiguadora de bloqueo a los pocillos de control del AM.
Método de titulación única: añadir una dilución de 1/5 de cada suero para análisis en una solución amortiguadora de bloqueo a los pocillos duplicados de las columnas 3 a 12 (10 µl suero +40 µl de solución amortiguadora de bloqueo),
o
Método de titulación del suero: preparar una serie de diluciones al 1/2 de cada muestra de ensayo (de 1/5 a 1/640) en una solución amortiguadora de bloqueo, en los ocho pocillos de una de las columnas 3 a 12.
4. Inmediatamente después de la incorporación de los sueros para análisis, diluir el AM a 1/100 en una solución amortiguadora de bloqueo y añadir 50 µl a todos los pocillos de la placa, excepto a los del ensayo en blanco.
5. Incubar a 37 °C durante 60 minutos en un agitador orbital. Lavar tres veces con una SAF y secar con papel secante.
6. Diluir a 1/5 000 el concentrado de conejo anti-ratón en una solución amortiguadora de bloqueo y añadir 50 µl a todos los pocillos de la placa.
7. Incubar a 37 °C durante 60 minutos en un agitador orbital. Lavar tres veces con una SAF y secar con papel secante.
8. Descongelar el diclorhidrato de o-fenilendiamina (OFD) e, inmediatamente antes del uso, añadir 5 µl de peróxido de hidrógeno al 30 % a cada alícuota de 10 ml de OFD. Añadir 50 µl a todos los pocillos de la placa. Tras 10 minutos aproximadamente de coloración, interrumpir la reacción con ácido sulfúrico 1 Molar (50 µl por pocillo). Deberá observarse una coloración en los pocillos de control del AM y en los que contengan sueros sin anticuerpos frente al virus de la FCO.
9. Examinar y registrar las placas visualmente o mediante un lector espectrofotométrico.
Análisis de los resultados:
Imprimir mediante un programa informático los valores de densidad óptica (DO) y de porcentaje de inhibición (PI) de los sueros para análisis y de los sueros de control a partir del valor medio registrado en los pocillos de control del antígeno. Los datos expresados como valores de DO y PI se emplean para determinar si la prueba funciona dentro de unos límites aceptables. Los límites superiores y los límites inferiores para el control del AM (el antígeno junto con el AM sin sueros para análisis) deben situarse entre los valores de 0,4 y 1,4 de DO. Deberá rechazarse toda placa que no cumpla los criterios citados.
Si no se dispone de ningún programa informático adecuado, imprimir los valores de DO utilizando la impresora ELISA. Calcular el valor medio de DO de los pocillos de control del antígeno, que es equivalente al valor 100 %. Determinar el valor de DO de un 50 % y calcular manualmente la positividad o negatividad de cada muestra.
Valor del porcentaje de inhibición (PI) = 100 – (DO de cada control de prueba / promedio de DO del Cm) × 100.
Los pocillos duplicados del suero de control negativo y los pocillos duplicados del blanco deberán registrar unos valores de PI comprendidos entre +25 % y –25 %, y entre +95 % y +105 %, respectivamente. Si los valores no están situados entre estos límites, la placa no queda invalidada, pero ello indica que se está desarrollando un color de fondo. Los sueros de control marcada y moderadamente positivos deberán registrar valores de PI comprendidos entre +81 % y +100 %, y entre +51 % y +80 %, respectivamente.
El umbral de diagnóstico de los sueros para análisis es el 50 % (PI del 50 % o DO del 50 %). Las muestras que registren valores de PI > 50 % son negativas. Se consideran dudosas las muestras que registren valores del PI superiores o inferiores al umbral en el caso de los pocillos duplicados. Dichas muestras pueden volver a analizarse con la prueba de dilución única o titularse. Las muestras positivas pueden también titularse para conocer el grado de positividad.
Lectura visual: las muestras positivas y negativas son fácilmente discernibles visualmente, pero las muestras marcadamente negativas y las muestras moderadamente positivas pueden resultar más difíciles de interpretar mediante un examen visual.
Preparación del antígeno del virus de la FCO para la prueba ELISA:
1. Lavar tres veces con medio de cultivo Eagle exento de suero entre 40 y 60 frascos de Roux de células confluentes BHK-21 e inocular el virus de la FCO del serotipo 1 en dicho medio.
2. Incubar a 37 °C y comprobar diariamente si se produce el efecto citopático (ECP).
3. Cuando dicho ECP se ponga de manifiesto en la capa celular de cada frasco de Roux, entre el 90 % y el 100 %, recoger el virus desprendiendo por agitación las células que hayan quedado adheridas al cristal.
4. Centrifugar a una velocidad entre 2000 y 3000 rpm para que sedimenten las células.
5. Desechar el sobrenadante y efectuar una nueva suspensión celular en 30 ml aproximadamente de una SAF que contenga un 1 % de sarkosil y 2 ml de fluoruro de fenilmetilsulfonilo (solución amortiguadora de lisis). Es posible que se gelifiquen las células, en cuyo caso podrá añadirse más solución amortiguadora de lisis para reducir el efecto. (Atención: el fluoruro de fenilmetilsulfonilo es nocivo, debe manipularse con sumo cuidado).
6. Romper las células aplicando una sonda ultrasónica de 30 micrones de amplitud durante 60 segundos.
7. Centrifugar a 10000 rpm durante 10 minutos.
8. Guardar el sobrenadante a +4 °C y efectuar una nueva suspensión del sedimento celular restante en 10-20 ml de solución amortiguadora de lisis.
9. Someter a ultrasonidos y clarificar tres veces en total, guardando el sobrenadante en cada fase.
10. Reunir los sobrenadantes y centrifugar durante 120 minutos a 24000 rpm (100,000 g) y a una temperatura de +4 °C sobre una almohadilla de 5 ml de sacarosa al 40 % (p/v en una SAF), utilizando tubos de centrifugado Beckmann de 30 ml y un rotor SW 28.
11. Desechar el sobrenadante, escurrir bien los tubos y efectuar una nueva suspensión del sedimento en una SAF mediante un baño de ultrasonidos. Guardar el antígeno en partes alícuotas a –20 °C.
Titulación del antígeno del virus de la FCO para la prueba ELISA:
El antígeno de la FCO para la prueba ELISA se titula mediante el método ELISA indirecto. Se titulan las diluciones a 1/2 del antígeno ante una dilución constante (1/100) del anticuerpo monoclonal 3-17-A3. El protocolo es el siguiente:
1. Titular una dilución 1/20 del antígeno del virus de la FCO en una SAF en la placa de microtitulación en una serie de diluciones a 1/2 (50 µl por pocillo) empleando una pipeta multicanal.
2. Incubar durante 1 hora a 37 °C en un agitador orbital.
3. Lavar las placas tres veces con una SAF.
4. Añadir a cada pocillo de la placa de microtitulación 50 µl del anticuerpo monoclonal 3-17-A3 (diluido a 1/100).
5. Incubar durante 1 hora a 37 °C en un agitador orbital.
6. Lavar las placas tres veces con una SAF.
7. Añadir a cada pocillo de la placa de microtitulación 50 µl de globulina de conejo anti-ratón conjugada con peroxidasa de rábano, diluida a una concentración óptima previamente titulada.
8. Incubar durante 1 hora a 37 °C en un agitador orbital.
9. Añadir el sustrato y el cromógeno como se ha descrito anteriormente. Transcurridos 10 minutos, interrumpir la reacción añadiendo ácido sulfúrico 1 M (50 µl/pocillo).
En el método competitivo, debe haber un exceso de anticuerpo monoclonal; por lo tanto se utilizará una dilución de antígeno comprendida dentro de la curva de titulación (no en la región plana) que dé un valor de DO de aproximadamente 0,8 después de 10 minutos.
B) La prueba de inmunodifusión en gel de agar deberá efectuarse de conformidad con el protocolo siguiente:
Antígeno:
El antígeno precipitante deberá prepararse en un cultivo celular que favorezca la multiplicación rápida de una cepa de referencia del virus de la FCO. Se recomienda la utilización de células BHK o Vero. Al finalizar el crecimiento del virus, el antígeno se encontrará en el líquido sobrenadante, pero para que resulte efectivo, se requiere una concentración de 50 a 100 veces superior. Esto es viable si se aplica un procedimiento normalizado de concentración de proteínas. El virus existente en el antígeno podrá inactivarse con la adición de 0,3 % (v/v) de betapropiolactona.
Suero de control positivo conocido:
Con el suero y el antígeno de referencia internacional, preparar un suero patrón nacional normalizado con relación al suero de referencia internacional para obtener una proporción óptima, liofilizarlo y emplearlo como suero de control positivo conocido en cada prueba.
Suero para análisis
Procedimiento: Preparar agarosa al 1 % en una solución amortiguadora de borato o de barbitol sódico, con un pH de 8,5 a 9,0, y verterla en una placa Petri hasta una altura mínima de 3,0 mm. Perforar en el agar siete pocillos libres de humedad, de 5,0 mm de diámetro cada uno. Se dispondrán del siguiente modo: un pocillo central, rodeado de los otros seis pocillos, que formarán un círculo de 3 cm de radio. El pocillo central se llenará con el antígeno patrón. Los pocillos periféricos 2, 4 y 6 se llenarán con el suero positivo conocido y los pocillos 1, 3 y 5 con los sueros para análisis. Incubar durante 72 horas como máximo, a temperatura ambiente, en una cámara cerrada y húmeda.
Interpretación: Un suero para análisis se considera positivo si forma una línea de precipitina específica con el antígeno y una línea completa de identidad con el suero de control. Un suero para análisis se considera negativo si no forma una línea específica con el antígeno y no desvía la línea del suero de control. Las placas Petri deberán examinarse sobre fondo oscuro con iluminación indirecta.
Enfermedad hemorrágica epizoótica (EHE)
La prueba de inmunodifusión en gel de agar deberá efectuarse de conformidad con el protocolo siguiente:
Antígeno:
El antígeno precipitante deberá prepararse en un cultivo celular que favorezca la multiplicación rápida del serotipo o serotipos adecuados del virus de la enfermedad hemorrágica epizoótica. Se recomienda la utilización de células BHK o Vero. Al finalizar el crecimiento del virus, el antígeno se encontrará en el líquido sobrenadante, pero para que resulte efectivo, se requiere una concentración de 50 a 100 veces superior. Esto es viable si se aplica un procedimiento normalizado de concentración de proteínas. El virus existente en el antígeno podrá inactivarse con la adición de 0,3 % (v/v) de betapropiolactona.
Suero de control positivo conocido:
Con el suero y el antígeno de referencia internacional, preparar un suero patrón nacional normalizado con relación al suero de referencia internacional para obtener una proporción óptima, liofilizarlo y emplearlo como suero de control positivo conocido en cada prueba.
Suero para análisis
Procedimiento: Preparar agarosa al 1 % en una solución amortiguadora de borato o de barbitol sódico, con un pH de 8,5 a 9,0, y verterla en una placa Petri hasta una altura mínima de 3,0 mm. Perforar en el agar siete pocillos libres de humedad, de 5,0 mm de diámetro cada uno. Se dispondrán del siguiente modo: un pocillo central, rodeado de los otros seis pocillos, que formarán un círculo de 3 cm de radio. El pocillo central se llenará con el antígeno patrón. Los pocillos periféricos 2, 4 y 6 se llenarán con el suero positivo conocido y los pocillos 1, 3 y 5 con los sueros para análisis. Incubar durante 72 horas como máximo, a temperatura ambiente, en una cámara cerrada y húmeda.
Interpretación: Un suero para análisis se considera positivo si forma una línea de precipitina específica con el antígeno y una línea completa de identidad con el suero de control. Un suero para análisis se considera negativo si no forma una línea específica con el antígeno y no desvía la línea del suero de control. Las placas Petri deberán examinarse sobre fondo oscuro con iluminación indirecta.
Rinotraqueítis infecciosa bovina (RIB) / Vulvovaginitis pustular infecciosa (VPI)
A) La prueba de seroneutralización deberá efectuarse con arreglo al protocolo siguiente:
Suero: Antes de su utilización, deberán inactivarse todos los sueros mediante calor a 56 °C durante 30 minutos.
Procedimiento: La prueba de seroneutralización constante con diferentes tipos de virus se realizará por placa de microtitulación mediante células MDBK u otras células sensibles. Deberán utilizarse las cepas Colorado, Oxford o cualquier otra cepa de referencia del virus, en una dosis de 100 DICT50 por 0,025 ml; se mezclarán muestras de suero inactivado sin diluir con un volumen igual (0,025 ml) de suspensión de virus. Incubar las mezclas virus/suero durante 24 horas a 37 °C en placas de microtitulación antes de añadir las células MDBK. Utilizar las células a una concentración que forme una monocapa completa tras 24 horas.
Controles: i) control del carácter infeccioso del virus, ii) control de la toxicidad del suero, iii) control de cultivos celulares no inoculados, y iv) antisueros de referencia.
Interpretación: Los resultados de la prueba de neutralización y el título del virus utilizado quedarán registrados previa incubación de tres a seis días a 37 °C. El suero se considerará negativo cuando no haya neutralización a la dilución de 1/2 (suero sin diluir).
B) Cualquier otra prueba reconocida en el marco de la Decisión 2004/558/CE de la Comisión [10].
Fiebre aftosa (FA)
A) La toma de muestras de esófago y faringe y los análisis deberán efectuarse de conformidad con el protocolo siguiente:
Reactivos: Antes de efectuar la toma de muestras, preparar el medio de transporte. Verter volúmenes de 2 ml en cada uno de los recipientes, cuyo número deberá ser igual al de animales examinados. Los recipientes utilizados deberán ser resistentes a la congelación en CO2 sólido o nitrógeno líquido. Las muestras se tomarán empleando un instrumento de recogida de esputos especialmente diseñado a tal efecto ("probang" o sonda esofágica). Para extraer la muestra, introducir dicha sonda esofágica por la boca, pasando por encima de la lengua y descendiendo por la faringe, hasta alcanzar la parte superior del esófago. Raspar la superficie epitelial de la parte superior del esófago y la faringe mediante movimientos dirigidos lateral y dorsalmente. A continuación, extraer la sonda, preferentemente después de que el animal haya efectuado un movimiento de deglución. Deberá estar llena y contener una mezcla de mucosidades, saliva, líquido esofágico y restos de células. Deberá procurarse que cada muestra contenga material celular visible. Se evitará realizar la operación con brusquedad, a fin de no ocasionar heridas que sangren. Es posible que las muestras de algunos animales estén muy contaminadas con contenido ruminal. En tal caso, se desecharán esas muestras y se lavará la boca del animal con agua, o, de preferencia, suero fisiológico, antes de repetir la toma de muestras.
Tratamiento de las muestras: Se examinará la calidad de cada muestra recogida con la sonda esofágica y se agregarán 2 ml de cada muestra a un volumen equivalente de medio de transporte dentro de un recipiente resistente a la congelación. Los recipientes serán cerrados herméticamente, precintados, desinfectados y etiquetados. Las muestras se mantendrán refrigeradas (+4 °C) y se examinarán en un plazo de 3 o 4 horas, o se conservarán en hielo seco (–69 °C) o nitrógeno líquido y permanecerán congeladas hasta que se examinen. La sonda esofágica se desinfectará y se lavará con tres enjuagues de agua limpia antes de emplearla con otro animal.
Ensayo del virus de la fiebre aftosa: Las muestras se inocularán en cultivos celulares primarios de tiroides de bovino, utilizando un mínimo de 3 tubos por muestra. Pueden emplearse también otras células sensibles (como células primarias de riñón de bovino o porcino) sin olvidar que su sensibilidad frente a algunas cepas del virus de la FA es menor. Los tubos se incubarán a 37 °C en un aparato giratorio y se examinarán una vez al día durante 48 horas para comprobar si se ponen de manifiesto los efectos citopáticos (ECP). En caso negativo, se procederá al paso ciego de los cultivos a nuevos cultivos, que volverán a examinarse durante 48 horas. Deberá confirmarse la especificidad de los eventuales ECP.
Medio de transporte recomendado:
1. Solución amortiguadora de fosfato 0,08 M, con pH de 7,2, que contenga un 0,01 % de seroalbúmina bovina, un 0,002 % de rojo de fenol y antibióticos.
2. Medio de cultivo tisular (por ejemplo, medio mínimo esencial de Eagle), con pH de 7,2, que contenga un 0,04 M de solución amortiguadora Hepes, un 0,01 % de seroalbúmina bovina y antibióticos.
3. Al medio de transporte deberán añadirse antibióticos (por ml de volumen final) como los siguientes: 1000 UI de penicilina, 100 UI de sulfato de neomicina, 50 UI de sulfato de polimixina B y 100 UI de micostatina.
B) La prueba de neutralización vírica deberá efectuarse con arreglo al protocolo siguiente:
Reactivos: Preparar la solución madre de antígeno del virus de la FA en cultivos celulares o en lenguas de bovino y almacenar a temperatura igual o inferior a –70 °C, o bien a –20 °C después de la adición de un 50 % de glicerol. Esto constituye la solución madre de antígeno. El virus de la FA se mantiene estable en estas condiciones y los títulos apenas varían a lo largo de varios meses.
Procedimiento: El análisis se efectúa empleando placas de microtitulación de fondo plano adecuadas para cultivos tisulares y se utilizan células sensibles, como las IB-RS-2, las BHK-21 o células de riñón de ternero. Efectuar una dilución a 1/4 de los sueros para análisis en un medio de cultivo celular exento de suero y añadir 100 UI/ml de neomicina o de otro antibiótico adecuado. Inactivar los sueros a 56 °C durante 30 minutos y emplear dosis de 0,05 ml para preparar una serie de diluciones a 1/2 en placas de microtitulación utilizando asas de 0,05 ml. A continuación, verter en cada pocillo virus previamente titulado, diluido asimismo en un medio de cultivo exento de suero, que contenga 100 DICT50 / 0,05 ml. Tras incubar a 37 °C durante 1 hora para que se produzca la neutralización, añadir a cada pocillo 0,05 ml de suspensión celular con 0,5 a 1,0 × 106 células/ml en un medio de cultivo celular que contenga suero exento de anticuerpos de la FA; a continuación, cerrar las placas de manera hermética. Incubar las placas a 37 °C. Normalmente, las monocapas confluyen en un plazo de 24 horas. Por lo general, a las 48 horas el ECP se ha desarrollado lo suficiente para permitir la lectura de la prueba con microscopio. En ese momento puede efectuarse la lectura microscópica definitiva o pueden fijarse y teñirse las placas para realizar una lectura macroscópica, utilizando, por ejemplo, una solución salina con un 10 % de formol y un 0,05 % de azul de metileno.
Controles: En cada prueba se efectuarán los siguientes controles: antisuero homólogo de título conocido, control celular, control de la toxicidad del suero, control del medio y una titulación del virus a partir de la cual se calcula la cantidad real de virus en la prueba.
Interpretación: Se considerarán infectados los pocillos con signos de ECP, y los títulos de neutralización se expresarán como el inverso de la dilución final de suero presente en las mezclas de suero y virus correspondiente al criterio del 50 % calculado con arreglo al método Spearman-Karber (Karber, G., 1931, Archiv für Experimentelle Pathologie und Pharmokologie, 162, 480). Las pruebas se considerarán válidas cuando la cantidad real de virus utilizada en cada pocillo de la prueba esté comprendida entre 101,5 y 102,5 DICT50 y cuando el título del suero de referencia no rebase el doble del título previsto, calculado en función de titulaciones anteriores. Cuando los controles no se ajusten a estos límites, se repetirán las pruebas. Se considerará negativo un título igual o inferior a 1/11.
C) La detección y cuantificación de anticuerpos con el método ELISA deberá efectuarse de conformidad con el protocolo siguiente:
Reactivos: Antisueros de conejo frente al antígeno 146S de siete tipos de virus de la FA, utilizados a una concentración óptima determinada previamente en una solución amortiguadora de carbonato/bicarbonato, siendo el pH de 9,6. Los antígenos se preparan a partir de cepas seleccionadas de virus cultivados en monocapas de células BHK-21. Los sobrenadantes no purificados se utilizan y titulan previamente de conformidad con el protocolo (aunque sin suero), de modo que se obtenga una dilución que, tras la adición de un volumen igual de una SAFT (solución salina amortiguadora de fosfatos con 0,05 % de Tween-20 e indicador de rojo de fenol), dé una lectura de la densidad óptica comprendida entre 1,2 y 1,5. Los virus pueden emplearse inactivados. La SAFT se utiliza como diluyente. Los antisueros de cobayas se preparan mediante la inoculación a estas de antígeno 146S de cada serotipo. Se prepara una concentración óptima determinada previamente en una SAFT con un 10 % de suero bovino normal y un 5 % de suero de conejo normal. Se utiliza inmunoglobulina de conejo anticobaya, conjugada con peroxidasa de rábano, a una concentración óptima determinada previamente en una SAFT con un 10 % de suero bovino normal y un 5 % de suero de conejo normal. Los sueros para análisis se diluyen en una SAFT.
Procedimiento:
1. Las placas ELISA se recubren con 50 µl de sueros antivíricos de conejo y se mantienen así hasta el día siguiente en una cámara húmeda a temperatura ambiente.
2. Preparar, en placas de fondo con forma de U con pocillos múltiples (placas portadoras), 50 µl de una serie duplicada de cada suero para análisis con diluciones a 1/2, empezando en 1/4. Añadir a cada pocillo 50 µl de una dosis constante de antígeno y dejar reposar las mezclas hasta el día siguiente a 4 °C. La adición del antígeno lleva a 1/8 la dilución inicial de suero.
3. Lavar cinco veces las placas ELISA con una SAFT.
4. Transvasar 50 µl de las mezclas de suero y antígeno desde las placas portadoras a las placas ELISA recubiertas de suero de conejo, e incubar a 37 °C durante 1 hora en un agitador rotatorio.
5. Después de lavar, añadir a cada pocillo 50 µl del antisuero de cobaya frente al antígeno utilizado en el punto 4. Incubar las placas a 37 °C durante 1 hora en un agitador rotatorio.
6. Lavar las placas y añadir a cada pocillo 50 µl de inmunoglobulina de conejo anticobaya, conjugada con peroxidasa de rábano. Incubar las placas a 37 °C durante 1 hora en un agitador rotatorio.
7. Lavar las placas y añadir a cada pocillo 50 µl de ortofenilendiamina con 0,05 % de H2O2 (30 %) p/v.
8. Transcurridos 15 minutos, interrumpir la reacción con 1,25 M de H2SO4.
Efectuar la lectura de las placas con un espectrofotómetro a 492 nm en un lector ELISA conectado a un microordenador.
Controles: Por cada antígeno utilizado, 40 pocillos no contendrán suero, sino antígeno diluido en una SAFT. Una serie duplicada de diluciones a 1/2 de antisuero bovino de referencia homólogo. Una serie duplicada de diluciones a 1/2 de suero bovino negativo.
Interpretación: El título de los anticuerpos se expresa como la dilución final del suero para análisis que dé el 50 % del valor medio de DO registrado en los pocillos de control del virus donde no haya suero para análisis. Los títulos superiores a 1/40 se considerarán positivos.
Referencias: Hamblin C. Barnett ITR y Hedger RS (1986), Un nuevo ensayo con sustancias inmunoabsorbentes unidas a enzimas (ELISA) para la detección de anticuerpos del virus de la fiebre aftosa. I. ELISA: desarrollo y método. Journal of Immunological Methods, 93, 115 a 121.11.
Enfermedad de Aujeszky (EAJ)
A) La prueba de seroneutralización deberá efectuarse con arreglo al protocolo siguiente:
Suero: Antes de su utilización, deberán inactivarse todos los sueros mediante calor a 56 °C durante 30 minutos.
Procedimiento: La prueba de seroneutralización constante con diferentes tipos de virus se efectuará en placas de microtitulación con células Vero u otros sistemas celulares sensibles. El virus de la enfermedad de Aujeszky deberá utilizarse en una dosis de 100 DICT50 por 0,025 ml; se mezclarán muestras de suero inactivado sin diluir con un volumen equivalente (0,025 ml) de suspensión de virus. Incubar las mezclas virus/suero durante 2 horas a 37 °C en placas de microtitulación antes de añadir las células adecuadas. Utilizar las células a una concentración que forme una monocapa completa tras 24 horas.
Controles: i) control del carácter infeccioso del virus, ii) control de la toxicidad del suero, iii) control de cultivos celulares no inoculados, y iv) antisueros de referencia.
Interpretación: Los resultados de la prueba de neutralización y el título del virus utilizado se registrarán después de tres a siete días de incubación a 37 °C. Se considerarán negativos los sueros cuyos títulos sean inferiores a 1/2 (suero sin diluir).
B) Cualquier otra prueba reconocida en el marco de la Decisión 2008/185/CE [11].
Gastroenteritis transmisible (GET)
La prueba de seroneutralización deberá efectuarse con arreglo al protocolo siguiente:
Suero: Antes de su utilización, deberán inactivarse todos los sueros mediante calor a 56 °C durante 30 minutos.
Procedimiento: La prueba de seroneutralización constante con diferentes tipos de virus se efectuará en placas de microtitulación con células A72 (tumor de perro) u otros sistemas celulares sensibles. El virus de la gastroenteritis transmisible deberá utilizarse en una dosis de 100 DICT50 por 0,025 ml; se mezclarán muestras de suero inactivado sin diluir con un volumen equivalente (0,025 ml) de suspensión de virus. Incubar las mezclas de virus/suero entre 30 y 60 minutos a 37 °C en las placas de microtitulación antes de añadir las células adecuadas. Utilizar las células a una concentración que forme una monocapa completa tras 24 horas. A cada pocillo se añadirán 0,1 ml de suspensión celular.
Controles: i) control del carácter infeccioso del virus, ii) control de la toxicidad del suero, iii) control de cultivos celulares no inoculados, y iv) antisueros de referencia.
Interpretación: Los resultados de la prueba de neutralización y el título del virus utilizado se registrarán después de tres a cinco días de incubación a 37 °C. Se considerarán negativos los sueros cuyos títulos sean inferiores a 1/2 (dilución final). Si las muestras de suero sin diluir son tóxicas para los cultivos de tejidos, los sueros podrán diluirse a 1/2 antes de ser utilizados. Esto equivaldría a una dilución final del suero de 1/4. En este caso, se considerarán negativos los sueros cuyos títulos sean inferiores a 1/4 (dilución final).
Enfermedad vesicular porcina (EVP)
Las pruebas para el diagnóstico de la enfermedad vesicular porcina deberán efectuarse de conformidad con la Decisión 2000/428/CE [12].
Peste porcina clásica (PPC)
Las pruebas para el diagnóstico de la peste porcina clásica deberán efectuarse de conformidad con la Decisión 2002/106/CE [13].
La realización de las pruebas de la peste porcina clásica deberá ajustarse a las directrices establecidas en el capítulo correspondiente del Manual de las Pruebas de Diagnóstico y de las Vacunas para los Animales Terrestres de la OIE.
La evaluación de la sensibilidad y especificidad de la prueba serológica de la peste porcina clásica deberá llevarse a cabo en un laboratorio nacional que cuente con un sistema de garantía de la calidad. Debe demostrarse que las pruebas empleadas permiten reconocer una serie de sueros de referencia marcada y moderadamente positivos, así como detectar el anticuerpo en una fase inicial de infección y en la convalecencia.
PARTE 7
Condiciones zoosanitarias de importación y cuarentena respecto a los animales importados a San Pedro y Miquelón en un plazo inferior a los seis meses previos a su introducción en la Unión
(contempladas en el artículo 6)
Especies de animales cubiertas
Taxón
|
ORDEN |
FAMILIA |
GÉNERO Y ESPECIE |
|
Artiodáctilos |
Camélidos |
Camelus spp., Lama spp. y Vicugna spp. |
1. Los animales importados a San Pedro y Miquelón deben permanecer en un centro de cuarentena autorizado durante un mínimo de sesenta días antes de ser enviados a la Unión. Este periodo podrá prolongarse en función de las pruebas que se requieran para determinadas especies. Además, los animales deben cumplir los requisitos siguientes:
a) Pueden introducirse partidas distintas en el centro de cuarentena. Sin embargo, una vez entren en el centro de cuarentena, se considerará a todos los animales de la misma especie un grupo único, y se hará referencia a este como tal. El periodo de cuarentena del grupo entero comenzará cuando se haya introducido el último animal en el centro.
b) Dentro del centro de cuarentena, cada grupo específico de animales deberá permanecer aislado, sin contacto directo ni indirecto con otros animales, incluidos los de otras partidas que se encuentren en el centro.
Todas las partidas deben permanecer en centros de cuarentena autorizados y estar protegidas de insectos vectores.
c) En caso de que, durante el periodo de cuarentena, no se mantenga el aislamiento de un grupo de animales determinado por haber contacto con otros animales, el periodo de cuarentena deberá recomenzar durante el mismo número de días previsto inicialmente, a la entrada en el centro.
d) Los animales destinados a la Unión que pasen por un centro de cuarentena deberán cargarse y enviarse directamente a la Unión:
i) sin haber tenido contacto alguno con otros animales que no cumplan las normas veterinarias establecidas para la introducción de la correspondiente categoría de animales en la Unión;
ii) estando separados en partidas de manera que ninguna de ellas pueda tener contacto con otros animales cuya importación a la Unión no esté autorizada;
iii) transportados en vehículos o contenedores previamente limpiados y desinfectados con un desinfectante autorizado oficialmente en San Pedro y Miquelón por ser eficaz para el control de las enfermedades a que se hace referencia en el capítulo 2; los vehículos y contenedores estarán diseñados de tal forma que durante el transporte no puedan derramarse ni caer fuera heces, orina, yacija o pienso.
2. Las instalaciones de cuarentena deberán cumplir al menos los requisitos mínimos establecidos en el anexo B de la Directiva 91/496/CEE [14] y las condiciones siguientes:
a) estar supervisadas por un veterinario oficial;
b) estar situadas en el centro de una zona de, al menos, 20 km de diámetro en la que, según los datos oficiales, no se haya registrado ningún caso de fiebre aftosa como mínimo durante los treinta días anteriores a su utilización como centro de cuarentena;
c) haber sido, con anterioridad a su uso como centro de cuarentena, limpiadas y desinfectadas con un desinfectante autorizado oficialmente en San Pedro y Miquelón por ser eficaz para el control de las enfermedades a que se hace referencia en el capítulo 2;
d) disponer, en función de su capacidad de alojamiento de animales, de lo siguiente:
i) una nave de uso exclusivo para la permanencia en cuarentena de los animales que cuente con instalaciones adecuadas para el alojamiento de los animales;
ii) instalaciones adecuadas que:
- sean fáciles de limpiar y desinfectar en profundidad;
- incluyan espacios para una carga o descarga segura de los animales;
- cumplan todos los requisitos para el suministro de agua y alimentos a los animales;
- permitan dispensar fácilmente cualquier tratamiento veterinario necesario;
iii) unas salas de inspección y aislamiento adecuadas;
iv) un equipo adecuado para la limpieza y desinfección de dependencias y camiones;
v) una zona apropiada para el almacenamiento de piensos, yacija y estiércol;
vi) un sistema adecuado de recogida de aguas residuales;
vii) un despacho para el veterinario oficial;
e) cuando esté en funcionamiento, disponer de suficientes veterinarios para efectuar todas las tareas;
f) admitir solo animales que estén identificados individualmente, con el fin de garantizar la trazabilidad. A este efecto, el propietario o encargado del centro deberá asegurarse de que los animales admitidos estén identificados adecuadamente y vayan acompañados de los documentos sanitarios o los certificados pertinentes para cada especie y categoría. Además, el propietario o encargado del centro deberá dejar constancia en un registro o base de datos, durante un mínimo de tres años, del nombre del propietario y el origen de los animales que componen la partida, las fechas de entrada y salida de los animales de la partida, su número de identificación y su lugar de destino;
g) la autoridad competente determinará el procedimiento para la supervisión oficial de los centros de cuarentena y velará por que esta se lleve a cabo. La supervisión debe incluir inspecciones periódicas de los centros para verificar que se siguen cumpliendo las condiciones de la autorización. En caso de suspensión o retirada de la autorización, esta podrá otorgarse de nuevo cuando las autoridades competentes consideren que las instalaciones del centro de cuarentena vuelven a ajustarse plenamente a todas las disposiciones de las letras a) a g).
1. REQUISITOS GENERALES
Los animales deberán someterse a las pruebas que se exponen a continuación, que se realizarán a partir de muestras de sangre extraídas, salvo indicación en contrario, en el plazo de los veintiún días siguientes a la fecha en que comience el periodo de aislamiento.
Las pruebas de laboratorio deberán llevarse a cabo en un laboratorio autorizado de la Unión, y todas las pruebas junto con sus resultados y las certificaciones de vacunas o tratamientos administrados deberán adjuntarse al certificado sanitario.
A fin de reducir al mínimo las molestias a los animales, deberán agruparse las tomas de muestras, pruebas y vacunas, en la medida de lo posible, respetando no obstante los intervalos mínimos que exigen los protocolos de pruebas contemplados en la parte 2 del presente capítulo.
2. REQUISITOS ESPECÍFICOS
2.1 CAMÉLIDOS
2.1.1. Tuberculosis
a) Pruebas que deben realizarse: prueba de reacción intradérmica comparativa utilizando el derivado proteínico purificado (DPP) de la tuberculina (bovina o aviar), conforme a las normas de producción de turberculinas bovina y aviar que se describen en el anexo B, punto 2.1.2, de la Directiva 64/432/CEE.
La prueba se efectuará en la zona posterior del cuello (zona axilar) según la técnica que se describe en el anexo B, punto 2.2.4, de la Directiva 64/432/CEE.
b) Calendario: deben realizarse dos pruebas, la primera de ellas en el plazo de los dos días siguientes a la llegada del animal al centro de cuarentena y la segunda, cuarenta y dos días después de la primera.
c) Interpretación de los resultados:
La reacción debe considerarse:
- negativa si el aumento del grosor del pliegue de la piel es inferior a 2 mm;
- positiva si el aumento del grosor del pliegue de la piel es superior a 4 mm;
- dudosa si el aumento de grosor del pliegue de la piel se sitúa entre 2 mm y 4 mm, o bien es superior a 4 mm, pero inferior a la reacción al DPP aviar.
d) Actuación una vez obtenidos los resultados de las pruebas:
Deberá separarse del grupo a los animales que den positivo en la reacción intradérmica al DPP bovino y volver a someterse a los demás animales a la prueba a partir de, como mínimo, los cuarenta y dos días siguientes a la fecha de la prueba inicial que dio positivo, y esta nueva prueba se considerará la primera prueba descrita en la letra b).
Si más de un animal del grupo da positivo, no se permitirá la exportación a la Unión del grupo entero.
Si uno o más animales del mismo grupo presentan una reacción dudosa, deberá someterse al grupo de nuevo a la prueba a partir de, como mínimo, los cuarenta y dos días siguientes a la fecha de la prueba inicial de resultado dudoso, y esta nueva prueba se considerará la primera prueba descrita en la letra b).
2.1.2. Brucelosis
a) Pruebas que deben realizarse:
i) Brucella abortus: pruebas de rosa de Bengala y seroaglutinación que se describen en el anexo C, puntos 2.5 y 2.6 respectivamente, de la Directiva 64/432/CEE. En caso de que las pruebas den positivo, se realizará, para confirmar los resultados, la prueba de fijación del complemento según se describe en el anexo I, parte 6, del Reglamento (UE) nº 206/2010 (SANCO/4787/2009).
ii) Brucella melitensis: pruebas de rosa de Bengala y seroaglutinación que se describen en el anexo C, puntos 2.5 y 2.6 respectivamente, de la Directiva 64/432/CEE. En caso de que las pruebas den positivo, se realizará, para confirmar los resultados, la prueba de fijación del complemento según el método que se describe en el anexo C de la Directiva 91/68/CEE.
iii) Brucella ovis: prueba de fijación del complemento que se describe en el anexo D de la Directiva 91/68/CEE.
b) Calendario: deben realizarse dos pruebas, la primera de ellas en el plazo de los dos días siguientes a la llegada del animal al centro de cuarentena y la segunda, cuarenta y dos días después de la primera.
c) Interpretación de los resultados:
En el anexo C de la Directiva 64/432/CEE se define una reacción positiva a las pruebas.
d) Actuación una vez obtenidos los resultados de las pruebas:
Deberá separarse del grupo a los animales que den positivo en alguna de las pruebas y volver a someterse a los demás animales a la prueba a partir de, como mínimo, los cuarenta y dos días siguientes a la fecha de la prueba inicial que dio positivo, y esta nueva prueba se considerará la primera prueba descrita en la letra b).
Solo se permitirá la introducción en la Unión de los animales que hayan dado negativo en dos pruebas consecutivas efectuadas conforme a lo descrito en la letra b).
2.1.3. Fiebre catarral ovina y enfermedad hemorrágica epizoótica
a) Pruebas que deben realizarse: prueba de inmunodifusión en placas de gel de agar realizada conforme a lo descrito en el anexo I, parte 6, del Reglamento (UE) nº 206/2010 (SANCO/4787/2009).
En caso de que las pruebas den positivo, se someterá a los animales a la prueba ELISA competitiva que se describe en el anexo I, parte 6, del Reglamento (UE) nº 206/2010 (SANCO/4787/2009) para distinguir entre ambas enfermedades.
b) Calendario:
Los animales deben dar negativo en dos pruebas, la primera de ellas en el plazo de los dos días siguientes a su llegada al centro de cuarentena y la segunda, un mínimo de veintiún días después de la primera.
c) Actuación una vez obtenidos los resultados de las pruebas:
i) Fiebre catarral ovina (lengua azul)
Se separará del grupo a los animales que den positivo en la prueba ELISA descrita en el anexo I, parte 6, del Reglamento (UE) nº 206/2010 (SANCO/4787/2009) y se pondrá en cuarentena al resto de los animales del grupo durante cien días a partir de la fecha de la toma de muestras que dieron positivo. Solo se considerará que el grupo está indemne de la fiebre catarral ovina si en los controles periódicos que deben llevar a cabo los veterinarios oficiales durante el periodo de cuarentena no se ponen de manifiesto síntomas clínicos de la enfermedad, y el centro de cuarentena se mantiene libre de los vectores de esta enfermedad (los mosquitos Culicoides).
Si otros animales presentaran síntomas clínicos de la fiebre catarral ovina durante el periodo de cuarentena descrito en el párrafo anterior, no se permitirá la introducción en la Unión de ningún animal del grupo.
ii) Enfermedad hemorrágica epizoótica (EHE)
Se considerará casos positivos a los animales a los que, habiendo dado positivo en las pruebas, se les detecten anticuerpos de la enfermedad hemorrágica epizoótica al realizarse la prueba ELISA de confirmación; estos animales deberán separarse del resto del grupo, y el grupo entero deberá someterse a más pruebas, la primera de ellas un mínimo de veintiún días después de la fecha del diagnóstico positivo inicial y la segunda un mínimo de veintiún días después de la fecha de la prueba repetida, debiendo arrojar ambas resultados negativos.
Si otros animales dieran positivo en una o en ambas pruebas de repetición, se denegará la introducción del grupo entero en la Unión.
2.1.4. Fiebre aftosa (FA)
a) Pruebas que deben realizarse: pruebas de diagnóstico (prueba de probang —con sonda esofágica— y serología) utilizando las técnicas ELISA y de neutralización del virus de conformidad con los protocolos que se describen en el anexo I, parte 6, del Reglamento (UE) nº 206/2010 (SANCO/4787/2009).
b) Calendario: los animales deben dar negativo en dos pruebas, la primera de ellas en el plazo de los dos días siguientes a su llegada al centro de cuarentena y la segunda, un mínimo de cuarenta y dos días después de la primera.
c) Actuación una vez obtenidos los resultados de las pruebas: si cualquiera de los animales da positivo respecto al virus de la fiebre aftosa, ningún animal que se encuentre en el centro de cuarentena se considerará apto para su introducción en la Unión.
Nota: si se detectan anticuerpos en proteínas estructurales o no estructurales del virus de la fiebre aftosa, se considerarán producto de una infección previa de fiebre aftosa, independientemente de que los animales hayan sido vacunados con anterioridad o no.
2.1.5. Peste bovina
a) Pruebas que deben realizarse: puede optarse por la prueba ELISA competitiva que se describe en el Manual de las Pruebas de Diagnóstico y de las Vacunas para los Animales Terrestres de la OIE, prueba prescrita para el comercio internacional. También puede utilizarse la seroneutralización u otras pruebas reconocidas conforme a los protocolos que se describen en los capítulos pertinentes del citado Manual.
b) Calendario: se someterá a los animales a dos pruebas, la primera de ellas en el plazo de los dos días siguientes a su llegada al centro de cuarentena y la segunda, un mínimo de cuarenta y dos días después de la primera.
c) Actuación una vez obtenidos los resultados de las pruebas: si cualquiera de los animales da positivo respecto al virus de la peste bovina, ningún animal que se encuentre en el centro de cuarentena se considerará apto para su introducción en la Unión.
2.1.6. Estomatitis vesicular
a) Pruebas que deben realizarse: ELISA, la neutralización vírica u otras pruebas reconocidas conforme a los protocolos que se describen en los capítulos pertinentes del Manual de la OIE.
b) Calendario: se someterá a los animales a dos pruebas, la primera de ellas en el plazo de los dos días siguientes a su llegada al centro de cuarentena y la segunda, un mínimo de cuarenta y dos días después de la primera.
c) Actuación una vez obtenidos los resultados de las pruebas: si cualquiera de los animales da positivo respecto al virus de la estomatitis vesicular, ningún animal que se encuentre en el centro de cuarentena se considerará apto para su introducción en la Unión.
2.1.7. Fiebre del Valle del Rift
a) Pruebas que deben realizarse: ELISA, la neutralización vírica u otras pruebas reconocidas conforme a los protocolos que se describen en los capítulos pertinentes del Manual de la OIE.
b) Calendario: se someterá a los animales a dos pruebas, la primera de ellas en el plazo de los dos días siguientes a su llegada al centro de cuarentena y la segunda, un mínimo de cuarenta y dos días después de la primera.
c) Actuación una vez obtenidos los resultados de las pruebas: si se detecta que cualquiera de los animales haya estado expuesto al agente de la fiebre del Valle del Rift, ningún animal que se encuentre en el centro de cuarentena se considerará apto para su introducción en la Unión.
2.1.8. Dermatosis nodular contagiosa
a) Pruebas que deben realizarse: serología mediante ELISA, la neutralización vírica u otras pruebas reconocidas conforme a los protocolos que se describen en los capítulos pertinentes del Manual de la OIE.
b) Calendario: se someterá a los animales a dos pruebas, la primera de ellas en el plazo de los dos días siguientes a su llegada al centro de cuarentena y la segunda, un mínimo de cuarenta y dos días después de la primera.
c) Actuación una vez obtenidos los resultados de las pruebas: si se detecta que cualquiera de los animales haya estado expuesto a la dermatosis nodular contagiosa, ningún animal que se encuentre en el centro de cuarentena se considerará apto para su introducción en la Unión.
2.1.9. Fiebre hemorrágica del Congo y de Crimea
a) Pruebas que deben realizarse: ELISA, la neutralización vírica, la inmunofluorescencia u otras pruebas reconocidas.
b) Calendario: se someterá a los animales a dos pruebas, la primera de ellas en el plazo de los dos días siguientes a su llegada al centro de cuarentena y la segunda, un mínimo de cuarenta y dos días después de la primera.
c) Actuación una vez obtenidos los resultados de las pruebas: si se detecta que cualquiera de los animales haya estado expuesto al agente de la fiebre hemorrágica del Congo y de Crimea, ningún animal que se encuentre en el centro de cuarentena se considerará apto para su introducción en la Unión.
2.1.10. Surra (tripanosomiasis causada por Trypanosoma evansi —T. evansi—)
a) Pruebas que deben realizarse: puede identificarse este parásito en muestras de sangre concentrada conforme a los protocolos descritos en los capítulos pertinentes del Manual de la OIE.
b) Calendario: se someterá a los animales a dos pruebas, la primera de ellas en el plazo de los dos días siguientes a su llegada al centro de cuarentena y la segunda, un mínimo de cuarenta y dos días después de la primera.
c) Actuación una vez obtenidos los resultados de las pruebas: si se detecta la presencia de T. evansi en cualquier animal de una partida, el animal en cuestión no se considerará apto para su introducción en la Unión. Además, se someterá a los animales restantes del grupo a un tratamiento antiparasitario interno y externo mediante agentes adecuados que resulten efectivos contra T. evansi.
2.1.11. Fiebre catarral maligna
a) Pruebas que deben realizarse: detección del ADN vírico basada en la identificación mediante inmunofluorescencia o inmunocitoquímica, en consonancia con los protocolos descritos en los capítulos pertinentes del Manual de la OIE.
b) Calendario: se someterá a los animales a dos pruebas, la primera de ellas en el plazo de los dos días siguientes a su llegada al centro de cuarentena y la segunda, un mínimo de cuarenta y dos días después de la primera.
c) Actuación una vez obtenidos los resultados de las pruebas: si se detecta que cualquiera de los animales haya estado expuesto a la fiebre catarral maligna, ningún animal que se encuentre en el centro de cuarentena se considerará apto para su introducción en la Unión.
2.1.12. Rabia
Vacunación: se permitirá vacunar los animales contra la rabia cuando así lo requiera el Estado miembro de destino y se someta al animal a un análisis de sangre y a una prueba de seroneutralización para anticuerpos.
2.1.13. Leucosis bovina enzoótica (únicamente en caso de que los animales estén destinados a un Estado miembro o región oficialmente indemne de leucosis bovina enzóotica, conforme a lo dispuesto en el artículo 2, apartado 2, letra k), de la Directiva 64/432/CEE)
a) Pruebas que deben realizarse: las pruebas de inmunodifusión en placas de gel de agar o ELISA de bloqueo, conforme a los protocolos descritos en la última versión del Manual de la OIE.
b) Calendario: se someterá a los animales a dos pruebas, la primera de ellas en el plazo de los dos días siguientes a su llegada al centro de cuarentena y la segunda, un mínimo de cuarenta y dos días después de la primera.
c) Actuación una vez obtenidos los resultados de las pruebas: deberá separarse del grupo en el centro de cuarentena a los animales que den positivo en la prueba descrita en la letra a) y volver a someterse a los demás animales a la prueba a partir de, como mínimo, los veintiún días siguientes a la fecha de la prueba inicial que dio positivo; esta nueva prueba se considerará la primera prueba descrita en la letra b).
Solo se considerarán aptos para su introducción en la Unión los animales que hayan dado negativo en dos pruebas consecutivas efectuadas conforme a lo descrito en la letra b).
(*) Sin perjuicio de las exigencias específicas de certificación previstas en los correspondientes acuerdos de la Unión con terceros países.
(**) Exclusivamente para animales vivos distintos de los cérvidos.
(***) Certificados conformes al Acuerdo entre la Comunidad Europea y la Confederación Suiza sobre el comercio de productos agrícolas (DO L 114 de 30.4.2002, p. 132).
(****) Antigua República Yugoslava de Macedonia: la denominación definitiva de este país se decidirá cuando finalicen las negociaciones actuales en las Naciones Unidas.
(*****) Excluido Kosovo, que se encuentra actualmente bajo administración internacional conforme a la Resolución 1244 del Consejo de Seguridad de Naciones Unidas de 10 de junio de 1999.
(6) DO 121 de 29.7.1964, p. 1977/64.
(7) DO L 46 de 19.2.1991, p. 19.
() Táchese el país que no proceda.
() Serbia no incluye Kosovo, que se encuentra actualmente bajo administración internacional conforme a la Resolución 1244 del Consejo de Seguridad de Naciones Unidas de 10 de junio de 1999.
(10) DO L 249 de 23.7.2004, p. 20.
(11) DO L 59 de 4.3.2008, p. 19.
(12) DO L 167 de 7.7.2000, p. 22.
(13) DO L 39 de 9.2.2002, p. 71.
(14) DO L 268 de 24.9.1991, p. 56.
PARTE 1
Lista de terceros países, territorios o bien partes de terceros países o territorios [1]
TABLA OMITIDA EN PÁGINAS 68 A 72
PARTE 2
Modelos de certificados veterinarios
Modelos:
"BOV": modelo de certificado veterinario para carne fresca, incluida la carne picada, de bovino doméstico (comprendidas asimismo las especies de los géneros Bison y Bubalus y sus cruces).
"OVI": modelo de certificado veterinario para carne fresca, incluida la carne picada, de ovino (Ovis aries) y caprino (Capra hircus) doméstico.
"POR": modelo de certificado veterinario para carne fresca, incluida la carne picada, de porcino doméstico (Sus scrofa).
"EQU": modelo de certificado veterinario para carne fresca, a excepción de la carne picada, de solípedo doméstico (Equus caballus, Equus asinus y sus cruces).
"RUF": modelo de certificado veterinario para carne fresca, a excepción de los despojos y la carne picada, de animales no domésticos criados en explotación del orden de los artiodáctilos (excluidos los bovinos —también las especies de los géneros Bubalus y Bison y sus cruces—, Ovis aries, Capra hircus, los suidos y tayasuidos), y de las familias de los rinoceróntidos y elefántidos.
"RUW": modelo de certificado veterinario para carne fresca, a excepción de los despojos y la carne picada, de animales no domésticos en estado silvestre del orden de los artiodáctilos (excluidos los bovinos —también las especies de los géneros Bubalus y Bison y sus cruces—, Ovis aries, Capra hircus, los suidos y tayasuidos), y de las familias de los rinoceróntidos y elefántidos.
"SUF": modelo de certificado veterinario para carne fresca, a excepción de los despojos y la carne picada, de animales no domésticos criados en explotación pertenecientes a las familias de los suidos, tayasuidos o tapíridos.
"SUW": modelo de certificado veterinario para carne fresca, a excepción de los despojos y la carne picada, de animales no domésticos en estado silvestre pertenecientes a las familias de los suidos, tayasuidos o tapíridos.
"EQW": modelo de certificado veterinario para carne fresca, a excepción de los despojos y la carne picada, de solípedos en estado silvestre pertenecientes al subgénero de los Hippotigris (cebras).
GA (garantías adicionales)
"A" : garantías relativas a la maduración, la medición del pH y el deshuesado de la carne fresca, excepto los despojos, certificada de conformidad con los modelos de certificado veterinario BOV (punto II.2.6), OVI (punto II.2.6), RUF (punto II.2.7) y RUW (punto II.2.4).
"C" : garantías relativas a las pruebas de laboratorio para detectar la peste porcina clásica en las canales de las que procede la carne fresca certificada de conformidad con el modelo de certificado veterinario SUW (punto II.2.3.B).
"D" : garantías relativas al suministro de residuos alimenticios en la explotación o explotaciones de los animales de los que procede la carne fresca certificada de conformidad con el modelo de certificado veterinario POR [punto II.2.3, letra d)].
"E" : garantías relativas a las pruebas de detección de la tuberculosis en los animales de los que procede la carne fresca certificada de conformidad con el modelo de certificado veterinario BOV [punto II.2.4, letra d)].
"F" : garantías relativas a la maduración y el deshuesado de la carne fresca, excepto los despojos, certificada de conformidad con los modelos de certificados BOV (punto II.2.6), OVI (punto II.2.6), RUF (punto II.2.6) y RUW (punto II.2.7).
"G" : garantías relativas, por una parte, a la exclusión de despojos y médula espinal y, por otra, a la puesta a prueba y origen de los cérvidos en cuanto a la caquexia crónica, conforme a lo dispuesto en los modelos de certificado veterinario RUF (punto II.1.7) y RUW (punto II.1.8).
"H" : garantías suplementarias necesarias para Brasil en relación con los contactos entre animales, los programas de vacunación y la vigilancia; sin embargo, dado que el Estado de Santa Caterina en Brasil no vacuna contra la fiebre aftosa, la referencia a un programa de vacunación no es aplicable para la carne de animales originarios de este Estado y sacrificados en el mismo.












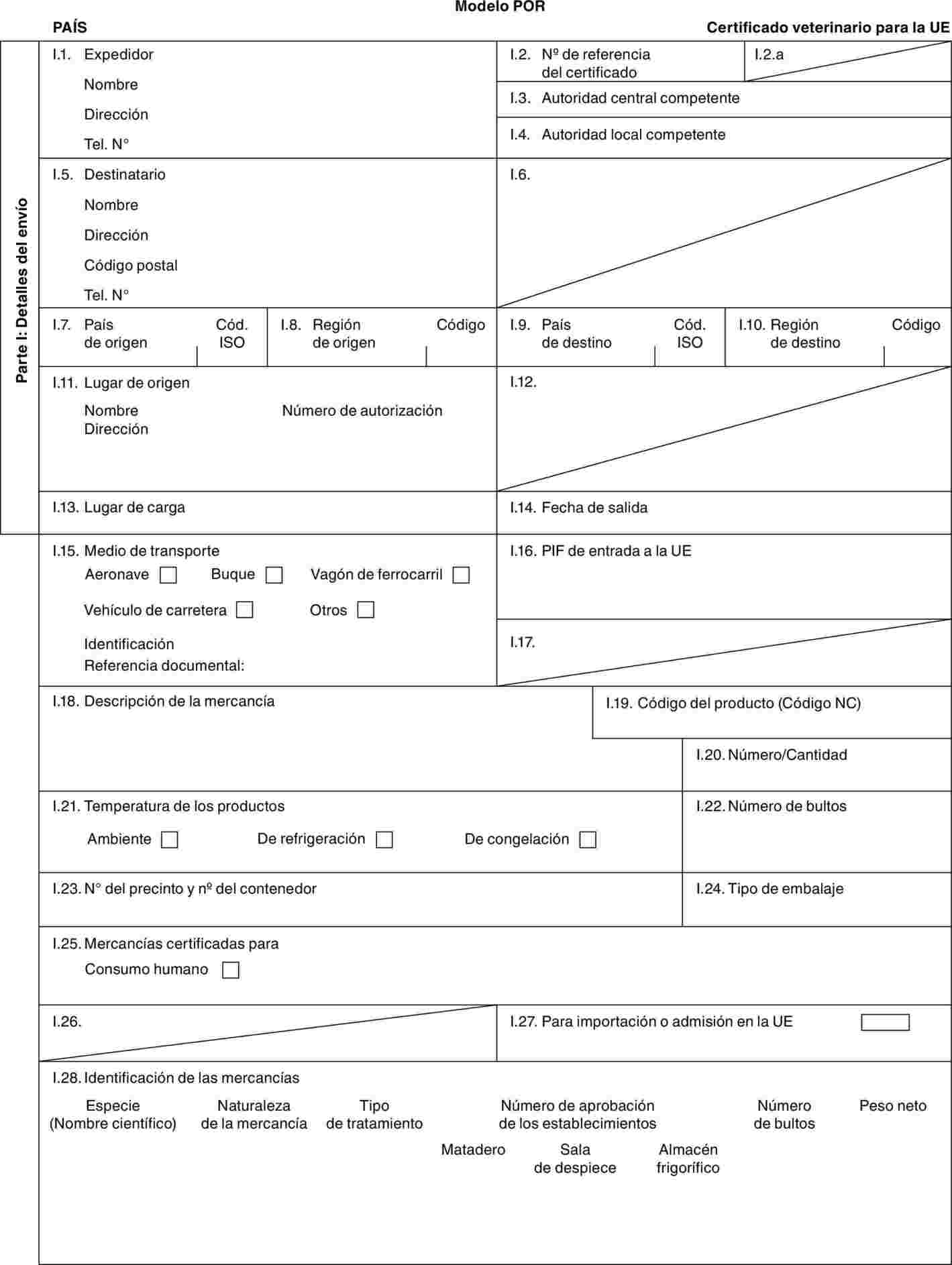



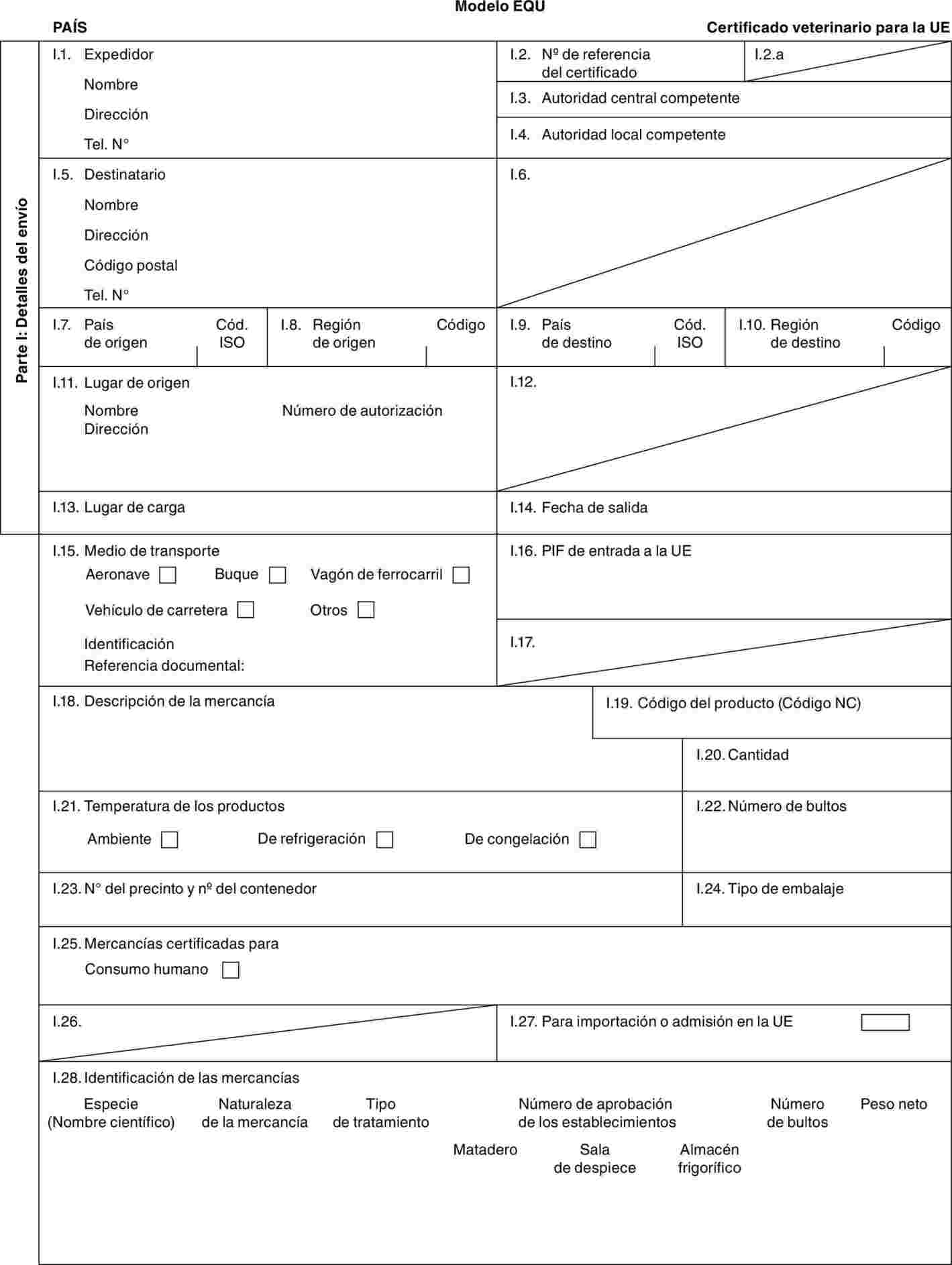






















(1) Sin perjuicio de requisitos específicos de certificación previstos en los correspondientes acuerdos de la Unión con terceros países.
(2) La carne de los animales sacrificados en la fecha indicada en la columna 7 o con anterioridad a la misma puede ser importada a la Unión durante los noventa días siguientes a dicha fecha. Las partidas transportadas en buques en alta mar que hayan sido certificadas antes de la fecha indicada en la columna 7 pueden importarse a la Unión durante los cuarenta días siguientes a dicha fecha. (N.B.: La ausencia de fecha en la columna 7 significa que no hay restricciones temporales.)
(3) Solo puede importarse a la Unión la carne de animales sacrificados en la fecha indicada en la columna 8 o con posterioridad a la misma (la ausencia de fecha en la columna 8 significa que no hay restricciones temporales).
(4) Antigua República Yugoslava de Macedonia; código provisional que en modo alguno prejuzga la nomenclatura definitiva de este país, que será acordada cuando concluyan las negociaciones que a este respecto tienen lugar actualmente en las Naciones Unidas.
(5) Excluido Kosovo, que se encuentra actualmente bajo administración internacional conforme a la Resolución 1244 del Consejo de Seguridad de Naciones Unidas de 10 de junio de 1999.



PARTE 1
Lista de terceros países, territorios o bien partes de terceros países o territorios
|
País/territorio |
Código de la parte del país o el territorio |
Descripción de la parte del país o el territorio |
|
US – Estados Unidos |
US-A |
El Estado de Hawai |
PARTE 2
Cuadros de animales con los modelos de certificado veterinario correspondientes
TABLA OMITIDA EN PÁGINA 116
PAÍS




(contempladas en el artículo 18)
a) El tercer país exportador expedirá los certificados veterinarios, basándose en los modelos que figuran en la parte 2 de los anexos I, II y IV y en el anexo III, y según la disposición del modelo correspondiente a los animales vivos o la carne en cuestión.
Los certificados deberán incluir, siguiendo el orden numérico del modelo, las declaraciones exigidas a todo tercer país y, según el caso, las garantías adicionales exigidas al tercer país exportador o a parte del mismo.
Si el Estado miembro de destino impone, en relación con determinados animales vivos o carne fresca, requisitos adicionales de certificación, se incorporarán al original del certificado veterinario declaraciones que certifiquen el cumplimiento de tales requisitos.
b) Cuando el modelo de certificado indique que debe tacharse lo que no proceda, el declarante puede tachar las declaraciones con su rúbrica y sello o eliminarlas completamente del certificado.
c) Deberá expedirse un certificado único y aparte para los animales vivos o la carne fresca exportados desde un territorio o territorios del mismo país exportador que figure(n) en las columnas 2 y 3 de la parte 1 de los anexos I, II o IV, con el mismo lugar de destino y transportados en el mismo vagón de ferrocarril, camión, buque o avión.
d) El original de cada certificado constará de una sola página o, si se necesita más espacio, estará configurado de manera que todas páginas en cuestión formen un todo integrado e indivisible.
e) El certificado veterinario estará redactado en, al menos, una de las lenguas oficiales del Estado miembro del puesto de inspección fronterizo de entrada de la partida en la Unión y del Estado miembro de destino. No obstante, los Estados miembros podrán aceptar certificados expedidos en la lengua oficial de otro Estado miembro acompañados, en su caso, de una traducción oficial.
f) Si por razones de identificación de los componentes de la partida (casilla del punto I.28 del modelo de certificado veterinario) se adjuntan páginas adicionales al certificado, estas se considerarán parte integrante del original siempre que consten la firma y el sello del veterinario oficial expedidor del certificado en cada una de ellas.
g) Cuando el certificado, incluidas las páginas adicionales contempladas en la nota f), tenga más de una página, cada una de ellas deberá ir numerada —(número de página) de (número total de páginas)— en la parte inferior y llevará en la parte superior el número de referencia del certificado que le haya atribuido la autoridad competente.
h) Deberá cumplimentar y firmar el original del certificado un veterinario oficial o inspector oficial designado cuando así lo disponga el modelo de certificado veterinario. Si se trata de partidas de animales vivos, deberá cumplimentarse y firmarse el certificado en el plazo de las veinticuatro horas previas a la carga de la partida para su introducción en la Unión. Las autoridades competentes del tercer país exportador garantizarán el cumplimiento de las normas de certificación equivalentes a las establecidas en la Directiva 96/93/CE [1].
El color de la firma deberá ser diferente al del texto impreso. La misma norma se aplica a los sellos distintos de los sellos en relieve o en filigrana.
i) Las autoridades competentes deberán asignar el número de referencia del certificado que se solicita en los puntos I.2 y II.a.
(1) DO L 13 de 16.1.1997, p. 28.
Agencia Estatal Boletín Oficial del Estado
Avda. de Manoteras, 54 - 28050 Madrid