El Real Decreto 1030/2006, de 15 de septiembre, por el que se establece la cartera de servicios comunes del Sistema Nacional de Salud y el procedimiento para su actualización recoge, en su anexo VII, el contenido de la prestación con productos dietéticos. El punto 2.3 de ese anexo, contempla que los productos dietéticos financiables son aquellos inscritos en el Registro General Sanitario de Alimentos como alimentos dietéticos destinados a usos médicos especiales e incluidos en la Oferta (Nomenclátor) de productos dietéticos, señalando que el procedimiento para la inclusión de productos en la Oferta se establecerá por orden ministerial.
En desarrollo de dicha disposición, la Orden SCO/3858/2006, de 5 de diciembre, por la que se regulan determinados aspectos relacionados con la prestación con productos dietéticos del Sistema Nacional de Salud estableció el procedimiento para la inclusión en la Oferta de los citados productos, así como el de alteración de la Oferta y los requisitos necesarios en cada caso.
El Real Decreto 1205/2010, de 24 de septiembre, por el que se fijan las bases para la inclusión de los alimentos dietéticos para usos médicos especiales en la prestación con productos dietéticos del Sistema Nacional de Salud y para el establecimiento de sus importes máximos de financiación, prevé en su artículo 4.3 que el Ministerio de Sanidad, Política Social e Igualdad establecerá el procedimiento para la aplicación de los importes máximos de financiación, tanto a los productos incluidos en la Oferta a la entrada en vigor de este real decreto como a aquellos cuya inclusión o alteración se solicite. Asimismo, en su artículo 7.1 dispone que el procedimiento para la inclusión en la Oferta, o para la alteración de las condiciones de oferta de un producto susceptible de encuadrarse en alguno de los tipos o subtipos recogidos en su anexo I se establecerá por orden de la persona titular del Ministerio de Sanidad, Política Social e Igualdad.
Por otra parte, la aplicación práctica de dicho real decreto requiere ampliar las funciones del Comité asesor para la prestación con productos dietéticos, con el fin de que los criterios para el establecimiento de importes máximos de financiación y para la inclusión de los alimentos dietéticos para usos médicos especiales en la Oferta de productos dietéticos del Sistema Nacional de Salud se determinen con la participación de las administraciones sanitarias implicadas en la gestión de la prestación con productos dietéticos.
Esta orden tiene por objeto hacer efectivas las referidas previsiones del Real Decreto 1205/2010, de 24 de septiembre y del Real Decreto 1030/2006, de 15 de septiembre, al establecer el procedimiento para la inclusión de un alimento dietético para usos médicos especiales en la Oferta de productos dietéticos del Sistema Nacional de Salud y para la alteración de las condiciones de oferta, así como para la aplicación de los importes máximos de financiación, además de ampliar las funciones del Comité asesor para la prestación con productos dietéticos.
En su tramitación ha informado preceptivamente la Comisión Interministerial para el estudio de los asuntos con transcendencia presupuestaria para el equilibrio financiero del Sistema Nacional de Salud o implicaciones económicas significativas, el Comité Consultivo del Sistema Nacional de Salud y el Consejo Interterritorial del Sistema Nacional de Salud. Asimismo, han sido oídos los sectores afectados y consultadas las Comunidades Autónomas.
Esta orden se dicta en uso de las atribuciones conferidas por la disposición final segunda del Real Decreto 1205/2010, de 24 de septiembre.
En su virtud, con la aprobación previa del Ministro de Política Territorial y Administración Pública, dispongo:
El objeto de esta norma es establecer el procedimiento para la inclusión de los alimentos dietéticos para usos médicos especiales en la Oferta de productos dietéticos del Sistema Nacional de Salud (en adelante Oferta) y para la aplicación de los importes máximos de financiación.
1. Se entiende por Oferta el conjunto de alimentos dietéticos destinados a usos médicos especiales con los que se hace efectiva la cartera de servicios comunes de prestación con productos dietéticos del Sistema Nacional de Salud.
2. Sólo serán financiables por el Sistema Nacional de Salud los productos dietéticos inscritos en el Registro General Sanitario de Alimentos como alimentos dietéticos destinados a usos médicos especiales e incluidos en la Oferta.
3. La Subdirección General de Alta Inspección y Cartera de Servicios del Ministerio de Sanidad, Política Social e Igualdad, en tanto que órgano responsable de la definición de la política de ordenación de prestaciones, mantendrá permanentemente actualizada la Oferta.
1. Cada una de las presentaciones de los alimentos dietéticos destinados a usos médicos especiales que se incluya en la Oferta se identificará con un código que a tal efecto le será asignado por el Ministerio de Sanidad, Política Social e Igualdad.
2. A efectos de la gestión y el control de la dispensación, así como de la facturación de los productos financiables por el Sistema Nacional de Salud, cada unidad de venta de los referidos productos irá provista, en su parte exterior, de un precinto identificativo con los datos del producto y las características que se señalan en el anexo I.
El uso de dicho precinto está reservado a los indicados productos, quedando prohibida su utilización en aquellas presentaciones a las que no se les haya concedido el código identificativo.
3. Las unidades de venta que se suministren directamente a los centros sanitarios no irán provistas del mencionado precinto identificativo o, en su caso, dicho precinto deberá haber sido previa y convenientemente inutilizado por la empresa comercializadora.
4. En todo caso y sin perjuicio de la información que deba incorporarse en el precinto, los productos incluidos en el ámbito de esta orden deberán cumplir todos los requisitos de etiquetado que les resulten de aplicación, conforme a lo dispuesto en el Real Decreto 1091/2000, de 9 de junio, por el que se aprueba la Reglamentación técnico-sanitaria específica de los alimentos dietéticos destinados a usos médicos especiales.
1. La empresa responsable de la comercialización de un alimento dietético para usos médicos especiales, que desee que sea financiado por el Sistema Nacional de Salud, deberá solicitarlo al Ministerio de Sanidad, Política Social e Igualdad cumplimentando, al efecto, la solicitud cuyo modelo figura en el anexo II, para cada una de las presentaciones del producto cuya financiación se pretenda. Este modelo de solicitud estará disponible en la página Web del Ministerio de Sanidad, Política Social e Igualdad.
Las solicitudes, se dirigirán a la Agencia Española de Seguridad Alimentaria y Nutrición e irán acompañadas de la documentación que en el citado anexo se especifica.
2. La Agencia Española de Seguridad Alimentaria y Nutrición dará traslado a la Subdirección General de Alta Inspección y Cartera de Servicios, órgano responsable de la instrucción del procedimiento, de la citada solicitud junto con la información precisa que permita valorar la procedencia o no de la financiación del producto y su proposición del tipo y subtipo que le corresponderían al producto en aplicación del Real Decreto 1205/2010, de 24 de septiembre.
1. La Subdirección General de Alta Inspección y Cartera de Servicios a la vista de la documentación recibida y teniendo en cuenta las características del producto, la normativa vigente reguladora de la prestación con productos dietéticos, así como los criterios propuestos por el Comité asesor para la prestación con productos dietéticos, determinará si el producto es susceptible o no de financiación, y en su caso, asignará a cada presentación el correspondiente código identificativo.
2. En el plazo máximo de seis meses, el titular de la Dirección General de Ordenación Profesional, Cohesión del Sistema Nacional de Salud y Alta Inspección, dictará resolución motivada que se notificará al interesado, con expresión de los recursos que procedan. Trascurrido dicho plazo sin que hubiera recaído resolución expresa, se podrá entender estimada la solicitud, en los términos previstos en el artículo 43 de la Ley 30/1992, de 26 de noviembre.
Esta resolución no pondrá fin a la vía administrativa, siendo recurrible en alzada, en el plazo de un mes, conforme a lo previsto en los artículos 114 y 115 de la Ley 30/1992, de 26 de noviembre, de Régimen Jurídico de las Administraciones Públicas y el Procedimiento Administrativo Común.
3. Cuando se determine la inclusión del producto en la Oferta, en la correspondiente resolución, se notificará al solicitante el código identificativo y el precio de oferta de cada presentación, así como el tipo y subtipo de producto asignado.
1. Los cambios en la composición, indicaciones, o en cualquiera de los datos recogidos en el precinto identificativo de una presentación incluida en la Oferta, así como en su precio de oferta, implican la necesidad de solicitar la correspondiente alteración de la Oferta.
2. No comportarán alteración de la Oferta las revisiones de precios de oferta como consecuencia de las actualizaciones generales de los importes máximos de financiación previstas en el artículo 5 del Real Decreto 1205/2010, de 24 de septiembre.
1. Cuando una alteración conlleve un cambio del precio de oferta, el nuevo precio no podrá exceder el importe máximo de financiación que le corresponda a la presentación en función del subtipo al que pertenezca tras el cambio. El nuevo precio se aplicará desde el momento en que se produzca la comercialización de los nuevos envases, salvo lo previsto en el apartado siguiente.
2. Si la alteración se refiere únicamente a un cambio en el precio de oferta, sin implicar otras modificaciones, el nuevo precio de oferta entrará en vigor a los tres meses de la notificación a la empresa de la aceptación de dicha alteración. En este supuesto, la aceptación del nuevo precio de oferta comportará que la empresa no podrá solicitar una nueva modificación del precio hasta que haya transcurrido, al menos, un año desde la fecha de la antes citada notificación de aceptación, salvo en el caso de las revisiones que determine el Ministerio de Sanidad, Política Social e Igualdad en base a lo establecido en el artículo 5 del Real Decreto 1205/2010, de 24 de septiembre.
1. Cuando la alteración de la Oferta esté motivada por una modificación sustancial de la composición que implique un nuevo tipo o subtipo, o por una modificación del tamaño del envase o del contenido del mismo se asignará un nuevo código identificativo a cada una de las presentaciones afectadas, con la consiguiente baja en la Oferta del código o códigos originales, que se llevará a cabo de forma simultánea a que se produzca la comercialización con el nuevo código.
2. Si la alteración de la Oferta de un producto conlleva la modificación de su subtipo, el precio de venta de la empresa de cada presentación de dicho producto se valorará en función del importe máximo de financiación que le corresponda en relación al nuevo subtipo.
1. Las empresas responsables de la comercialización de un alimento dietético que deseen realizar una alteración de su Oferta deberán solicitarlo al Ministerio de Sanidad, Política Social e Igualdad, mediante la cumplimentación del modelo que se establece en el anexo III, para cada una de las presentaciones del producto cuya alteración se pretenda. Este modelo de solicitud estará disponible en la página Web del Ministerio de Sanidad, Política Social e Igualdad.
2. Las solicitudes se dirigirán a la Agencia Española de Seguridad Alimentaria y Nutrición, y seguirán los mismos trámites previstos en los artículos 4 y 5.
1. Una vez aceptada la inclusión de un producto en la Oferta o la alteración de uno ya incluido, la empresa responsable de su comercialización deberá comunicar a la Dirección General de Ordenación Profesional, Cohesión del Sistema Nacional de Salud y Alta Inspección, con una antelación mínima de un mes, la fecha prevista para el inicio de la comercialización de cada una de las presentaciones del referido producto, adjuntando el precinto identificativo definitivo. Esta obligación no será de aplicación en el caso de las alteraciones de oferta previstas en el apartado 7.2.
2. Si transcurrido un plazo de seis meses, contados a partir de la fecha de notificación de la resolución de aceptación de la inclusión de un producto o de la aceptación de la alteración de la Oferta, no se produce su comercialización, se entenderá que la empresa en cuestión renuncia a su solicitud de inclusión o de alteración de la Oferta y, en consecuencia, se procederá a la anulación de la correspondiente inscripción y de su código identificativo.
3. Sin perjuicio de lo dispuesto en el apartado anterior, la empresa responsable podrá solicitar una prórroga del plazo indicado por un periodo máximo de tres meses, siempre que aporte causas suficientes y debidamente justificadas que le impidan la comercialización del producto en el plazo previsto.
4. Cuando se prevea o se produzca una suspensión temporal de la comercialización de un producto o de alguna de sus presentaciones, la empresa deberá comunicarlo, antes de la fecha en que ocurra este supuesto, para lo cual deberá cumplimentar el modelo que se recoge en el anexo IV. Este modelo de solicitud estará disponible en la página web del Ministerio de Sanidad, Política Social e Igualdad.
5. Si fuera a producirse un cese definitivo en la comercialización del producto, la empresa responsable deberá comunicarlo, con una antelación mínima de tres meses y utilizando para ello el modelo que se recoge en el anexo IV.
1. El Comité asesor para la prestación con productos dietéticos, adscrito a la Dirección General de Ordenación Profesional, Cohesión del Sistema Nacional de Salud y Alta Inspección, es el órgano colegiado coordinador entre las administraciones sanitarias implicadas en la gestión de esta prestación y tendrá como finalidad la coordinación de las actuaciones y el seguimiento de la prestación con productos dietéticos. Su actividad estará vinculada a la Comisión de prestaciones, aseguramiento y financiación, recogida en el artículo 9 del Real Decreto 1030/2006, de 15 de septiembre.
2. El Comité asesor para la prestación con productos dietéticos tendrá la siguiente composición:
a) Presidente: El Director General de Ordenación Profesional, Cohesión del Sistema Nacional de Salud y Alta Inspección.
b) Vocales:
Un representante designado por cada una de las Comunidades Autónomas.
Un representante designado por cada una de las siguientes mutualidades: Mutualidad General de Funcionarios Civiles del Estado (MUFACE), Mutualidad General Judicial (MUGEJU) e Instituto Social de las Fuerzas Armadas (ISFAS).
Un representante designado por cada uno de los siguientes organismos: Agencia Española de Seguridad Alimentaria y Nutrición; Instituto Nacional de Gestión Sanitaria; Instituto de Salud Carlos III.
Un representante de la Subdirección General de Alta Inspección y Cartera de Servicios.
Dos facultativos especialistas del Sistema Nacional de Salud, expertos en nutrición y dietética, designados por la persona titular del Ministerio de Sanidad, Política Social e Igualdad, previa consulta al Consejo Interterritorial del Sistema Nacional de Salud.
c) Secretario: Un funcionario de la Subdirección General de Alta Inspección y Cartera de Servicios, que actuará con voz pero sin voto.
3. Por cada vocal titular será designado un vocal suplente. Cuando concurran circunstancias debidamente justificadas, los vocales titulares podrán ser sustituidos por los respectivos suplentes. La sustitución deberá ser comunicada al secretario del Comité, como mínimo, veinticuatro horas antes de la fecha establecida para la celebración de la respectiva reunión.
4. Cuando la naturaleza de los temas así lo aconseje y por invitación del Presidente, podrán incorporarse al Comité, con voz pero sin voto, los expertos que se consideren necesarios, en calidad de asesores.
5. El Comité se reunirá con una periodicidad anual, pudiendo convocarse reuniones extraordinarias cuando se estime necesario. Cuando para su funcionamiento se considere preciso, podrán crearse grupos de trabajo, de carácter permanente o temporal, para el estudio de temas concretos relacionados con las materias de su competencia. Estos grupos se reunirán con la periodicidad que requiera la misión que se les encomiende.
6. El apoyo al Comité será prestado con los actuales medios humanos y materiales del Ministerio de Sanidad, Política Social e Igualdad, de modo que su funcionamiento no suponga incremento del gasto público.
7. Sin perjuicio de las peculiaridades previstas en esta orden, el Comité ajustará su funcionamiento a lo dispuesto en el Capítulo II del Título II «Órganos Colegiados», de la Ley 30/1992, de 26 de noviembre, de Régimen Jurídico de las Administraciones Públicas y del Procedimiento Administrativo Común.
Las funciones del Comité asesor para la prestación con productos dietéticos serán las siguientes:
a) Elaborar, aprobar y modificar el reglamento de régimen interior de funcionamiento del propio Comité.
b) Detectar las dificultades que pudieran surgir en el cumplimiento de la normativa relativa a la prestación con productos dietéticos y resolver las dudas sobre su interpretación y aplicación.
c) Proponer la actualización de los requisitos para el acceso a la prestación con productos dietéticos, así como de los criterios de asignación de tipo y subtipo de dichos productos y de su inclusión en la financiación, de las situaciones clínicas del paciente que justifiquen la necesidad de la indicación de estos tratamientos y de las patologías subsidiarias de nutrición enteral domiciliaria o de los trastornos metabólicos congénitos susceptibles de tratamientos dietoterápicos.
d) Proponer las bases para la revisión, detalle y actualización de los criterios para el establecimiento de importes máximos de financiación de los productos dietéticos y valorar anualmente la conveniencia de realizar una revisión de los importes máximos de financiación, elaborando en su caso, la propuesta que corresponda.
e) Proponer condiciones especiales de prescripción, dispensación y financiación de los alimentos dietéticos destinados a usos médicos especiales, ya incluidos en la prestación con productos dietéticos del Sistema Nacional de Salud.
f) Proponer la información sobre la prestación con productos dietéticos que se remitirá por parte de las Comunidades Autónomas, el Instituto Nacional de Gestión Sanitaria y las Mutualidades de funcionarios a la Dirección General de Ordenación Profesional, Cohesión del Sistema Nacional de Salud y Alta Inspección, a efectos de contar con un sistema de información que facilite la gestión y permita el seguimiento de la prestación con productos dietéticos.
g) Evaluar periódicamente la información sobre consumo de prestación con productos dietéticos y proponer las medidas que correspondan para un uso racional de los productos dietéticos.
h) Proponer criterios uniformes para la ejecución de la prestación con productos dietéticos del Sistema Nacional de Salud.
i) Emitir informe, cuando sea requerido para ello por el Consejo Interterritorial del Sistema Nacional de Salud o las administraciones sanitarias representadas en el Comité, sobre las cuestiones que afecten a las prestaciones con productos dietéticos.
j) Servir de cauce permanente de colaboración, comunicación e información entre los distintos Servicios de Salud de las Comunidades Autónomas, la Administración General del Estado y otros agentes implicados en la gestión de esta prestación.
k) Aquellas otras que puedan serle confiadas por el Ministerio de Sanidad, Política Social e Igualdad o por el Consejo Interterritorial del Sistema Nacional de Salud para la debida coordinación entre las administraciones sanitarias en materia de prestación con productos dietéticos.
1. Los alimentos dietéticos para usos médicos especiales que estuvieran incluidos en la Oferta a la fecha de entrada en vigor de la presente orden deberán adaptarse a lo recogido en el Real Decreto 1205/2010, de 24 de septiembre, y demás normativa reguladora de la prestación con productos dietéticos.
2. A tal efecto, en el plazo de dos meses siguientes a la fecha de entrada en vigor de esta disposición, las empresas responsables de la comercialización de los referidos productos deberán remitir a la Subdirección General de Alta Inspección y Cartera de Servicios la propuesta de precio de venta de la empresa mediante la solicitud de adaptación que figura en el anexo V, acompañada del etiquetado de cada producto. Este modelo de solicitud estará disponible en la página Web del Ministerio de Sanidad, Política Social e Igualdad.
3. En el plazo máximo de seis meses, desde la recepción de la información mencionada en el apartado 2, el titular de la Dirección General de Ordenación Profesional, Cohesión del Sistema Nacional de Salud y Alta Inspección, dictará resolución motivada, que se notificará al interesado con expresión de los recursos que procedan. Trascurrido dicho plazo sin que hubiera recaído resolución expresa, se podrá entender estimada la solicitud por silencio administrativo, en los términos previstos en el artículo 43 de la Ley 30/1992, de 26 de noviembre.
Estas resoluciones no pondrán fin a la vía administrativa, siendo recurribles en alzada, en el plazo de un mes, conforme a lo previsto en los artículos 114 y 115 de la Ley 30/1992, de 26 de noviembre.
4. La resolución que se dicte será conforme a alguno de los siguientes supuestos:
a) Resolverá su permanencia en la Oferta para aquellas presentaciones cuyo precio de venta de la empresa no supere el importe máximo de financiación correspondiente, según el subtipo al que pertenezcan, y que cumplan los demás requisitos establecidos en la normativa vigente en materia de prestación con productos dietéticos.
b) Resolverá la permanencia en la Oferta condicionada a su adecuación, para aquellas presentaciones cuyo precio de venta de la empresa supere el importe máximo de financiación correspondiente o para aquellas que no cumplan alguno de los requisitos establecidos en la normativa vigente en materia de prestación con productos dietéticos.
Cuando la resolución de permanencia condicionada en la Oferta sea debida a un precio de venta de la empresa superior al importe máximo de financiación, en el plazo máximo de un mes siguiente a la recepción de dicha notificación, la empresa deberá comunicar un precio de venta de la empresa ajustado al importe máximo de financiación en función del subtipo al que pertenece.
Cuando la resolución de permanencia en la Oferta condicionada sea debida al incumplimiento de alguno de los demás requisitos establecidos en la normativa vigente, en el mismo plazo antes indicado, la empresa deberá remitir un compromiso de adecuación de la presentación a la citada normativa, que deberá hacerse efectivo en el plazo máximo de los diez meses siguientes, mediante la presentación de la correspondiente solicitud de alteración de la Oferta.
c) Resolverá la exclusión de la Oferta para aquellas presentaciones para las que sus empresas no hayan remitido cumplimentada la solicitud de adaptación que figura en el anexo V o no se hayan adaptado a lo establecido en la normativa vigente y procederá a la consecuente cancelación de su inscripción.
5. En todos los casos de exclusión de la Oferta, se notificará una resolución debidamente motivada, que incluirá los recursos que procedan y los plazos para interponerlos.
Los procedimientos de inclusión o alteración de la Oferta que se encontraran en tramitación a la fecha de entrada en vigor de la presente disposición se resolverán de acuerdo con el procedimiento vigente con anterioridad a dicha fecha, si bien les será de aplicación lo previsto en el artículo 6 del Real Decreto 1205/2010, de 24 de septiembre.
Quedan derogadas cuantas disposiciones de igual o inferior rango se opongan a lo dispuesto en esta orden y en concreto la Orden SCO/3858/2006, de 5 de diciembre, por la que se regulan determinados aspectos relacionados con la prestación con productos dietéticos del Sistema Nacional de Salud.
La presente orden se dicta al amparo de lo dispuesto en el artículo 149.1.16ª de la Constitución, que atribuye al Estado la competencia exclusiva en materia de bases y coordinación general de sanidad.
1. Los precios de oferta se aplicarán a los diez meses de la fecha de entrada en vigor de la presente orden, momento a partir del cual las empresas comercializarán sus productos, a efectos de su financiación por el Sistema Nacional de Salud, al precio de oferta, salvo lo previsto en el apartado 2.
2. Cuando la adecuación de una presentación al importe máximo de financiación suponga una reducción superior al 10% del precio de venta sin impuestos comunicado por la empresa al Ministerio de Sanidad, Política Social e Igualdad en el año 2010, esta podrá solicitar que dicha adecuación se realice en dos etapas. La primera, aplicable a los diez meses de la entrada en vigor de esta norma, en la que el producto se financiará al importe resultante de reducir como mínimo un 10% el citado precio de venta, y la segunda, una vez transcurridos los seis meses siguientes, momento a partir del cual ya se financiará al precio de oferta.
Esta solicitud de adecuación en dos etapas se reflejará en el epígrafe correspondiente de la ficha que se recoge como anexo V.
3. Las Comunidades Autónomas, el Instituto Nacional de Gestión Sanitaria, la Mutualidad General de Funcionarios Civiles del Estado (MUFACE), la Mutualidad General Judicial (MUGEJU) y el Instituto Social de las Fuerzas Armadas (ISFAS), en sus respectivos ámbitos de gestión y a efectos de establecer los importes de facturación de las oficinas de farmacia o como referente máximo para la adquisición de productos dietéticos que faciliten a través de centros sanitarios a pacientes no ingresados, aplicarán los precios de oferta a los doce meses de la entrada en vigor de la presente orden, salvo para aquellos productos que, de acuerdo a lo señalado en el apartado 2, hayan solicitado la aplicación de los importes máximos en dos etapas, en cuyo caso a los doce meses se aplicará la cantidad aceptada en la primera etapa y seis meses después el precio de oferta.
La presente orden entrará en vigor el día siguiente al de su publicación en el «Boletín Oficial del Estado».
Madrid, 16 de noviembre de 2010.–La Ministra de Sanidad, Política Social e Igualdad, Leire Pajín Iraola.
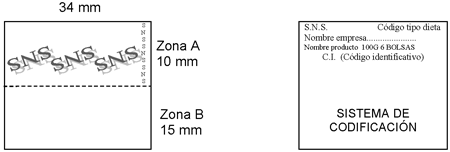
Cada unidad de venta de un producto dietético incluido en la Oferta de productos dietéticos del Sistema Nacional de Salud llevará en su parte exterior un precinto que identificará de forma inequívoca a cada presentación y que deberá reunir las siguientes características:
1. El precinto será autoadhesivo, extraíble, de modo que pueda ser utilizado como comprobante de la dispensación y estará dotado de las medidas de seguridad que se detallan en este anexo.
2. Las características del precinto serán tales que al separarlo no se produzca deterioro de la unidad de venta y en el espacio en el que estaba ubicado quede la siguiente frase con caracteres bien legibles: «DISPENSADO AL SNS». Tipo de letras: Arial 13 negrita de color rojo, pantone número 032, y con inclinación de texto: 30º.
3. Se procurará que la ubicación del precinto sea en una zona lo más visible posible de la unidad de venta y que esté dispuesto de forma que no se impida o dificulte la lectura óptica (es decir, que no esté situado en una arista para que no esté doblado o en una zona de fácil roce que haga que se deteriore, etc.).
4. El precinto estará formado por dos partes diferenciadas (zonas A y B) entre las que no existirá línea divisoria alguna ni señal impresa y que contendrán la siguiente información:
4.1 La zona A (parte superior), tendrá los siguientes datos:
a) Primera línea: Siglas S.N.S. (ajustadas a la izquierda) y código del tipo de producto dietético asignado por el órgano del Ministerio de Sanidad, Política Social e Igualdad responsable de la ordenación de prestaciones (ajustado a la derecha).
b) Segunda línea: Nombre de la empresa comercializadora (ajustado a la izquierda).
c) Tercera línea: Nombre del producto, contenido del envase (expresado en gramos o mililitros), número de envases incluidos en la unidad de venta y tipo de envase (botella, bolsa, etc.) (ajustado a la izquierda).
d) Cuarta línea: Código identificativo de la presentación asignado por el órgano del Ministerio de Sanidad, Política Social e Igualdad responsable de la ordenación de prestaciones precedido de las siglas C.I. (centrado).
Además, esta zona A llevará como medidas de seguridad:
a) Leyenda visible únicamente a la luz ultravioleta, que abarque esta zona del precinto, de forma cruzada al texto, en la que figure repetidas veces «SNS» con fuente Time Bold de 12 puntos y 45º de inclinación.
b) Texto en microimpresión situado junto al borde lateral derecho de la zona A en el que figure la leyenda «SNS» repetida con un cuerpo de 240 micras.
4.2 La zona B (parte inferior) que se irá adaptando a los avances que se produzcan en sistemas y tecnologías de la información, recogerá un código de barras EAN-13/SF con las debidas garantías de estandarización.
5. Todo el precinto llevará un fondo de seguridad con mensaje encriptado con el texto «SNS», que se leerá con una lente decodificadora. El fondo será contiguo de diseño de línea fina, en pantone 2995, de forma que posibilite la lectura automática de los códigos de barras.
6. Las dimensiones del precinto autoadhesivo serán de 34 mm de ancho por 25 mm de alto.
Zona A: Ancho 34 mm, alto 10 mm.
Zona B: Ancho 34 mm, alto 15 mm (Código de barras 30 mm × 15 mm).
Ejemplo de precinto identificativo autoadhesivo:
Con fecha / / se ha inscrito en el Registro General Sanitario de Alimentos el producto destinado a usos médicos especiales denominado ………..……….........…....…………. y con número de registro ……….................................................................................………
Considerando que cumple las condiciones establecidas en la normativa vigente reguladora de la prestación con productos dietéticos, especialmente lo establecido en el artículo 6 del Real Decreto 1205/2010, de 24 de septiembre, por el que se fijan las bases para la inclusión de los alimentos dietéticos para usos médicos especiales en la prestación con productos dietéticos del Sistema Nacional de Salud y el establecimiento de sus importes máximos de financiación.
Solicito: La inclusión de dicho producto en la Oferta de productos dietéticos del Sistema Nacional de Salud y la asignación del código identificativo establecido en el artículo 3 punto 1 de la Orden SIP/ /2010 de de , por la que se establece el procedimiento para la inclusión de los alimentos dietéticos para usos médicos especiales en la Oferta de productos dietéticos del Sistema Nacional de Salud y para la aplicación de los importes máximos de financiación, así como la asignación del tipo y subtipo de producto dietético correspondiente, de acuerdo con los anexos I y II del Real Decreto 1205/2010, de 24 de septiembre.
Para ello se adjunta:
|
– Ficha de datos técnicos (en esta ficha se reflejarán las diferentes presentaciones del producto para las que se solicita la inclusión en la oferta y asignación de código identificativo). |
|
– Composición cualitativa y cuantitativa del producto acompañada de una breve1 descripción del producto y del proceso de elaboración en la que se indiquen las materias primas utilizadas y se señale la fuente y tipo de: proteínas, hidratos de carbono, lípidos, y el contenido en micronutrientes (vitaminas y minerales), y la fuente y tipo de fibra, si la contiene. |
|
– Etiqueta original de cada presentación. |
|
– Boceto de precinto identificativo extraíble (tras la notificación de la resolución de inclusión en la Oferta se remitirá el precinto definitivo previamente a su puesta en el mercado). |
|
– Justificante de haber pagado las tasas señaladas en el art. 32 de la Ley 53/2002, de 30 de diciembre, de Medidas Fiscales, Administrativas y del Orden Social (Modelo 791 – código 607). |
Fecha y firma
Fdo.:
Como: ………………...…………… de la empresa …............…………………................
Subdirección General de Gestión de Riesgos Alimentarios.- Agencia Española de Seguridad Alimentaria y Nutrición. Ministerio de Sanidad, Política Social e Igualdad.
1 Que no exceda de 4 hojas DIN A4.
Nota: Presentar por duplicado.
Ficha de datos técnicos de las diferentes presentaciones del producto para el que se solicita la inclusión en la Oferta de productos dietéticos del Sistema Nacional de Salud y asignación de código identificativo

(Reverso de la Ficha de datos técnicos)
1 El nombre que se proponga deberá ser un nombre de fantasía o bien una denominación genérica acompañada de una marca comercial o del nombre del titular o fabricante del producto.
No deberá ser un nombre igual o similar al de otros productos dietéticos financiables o no financiables, al de medicamentos o al de productos sanitarios, de forma que su prescripción y dispensación no induzca a confusión respecto a otros productos de la misma u otra empresa. Asimismo el nombre no deberá llevar a error respecto a sus indicaciones. Además, en el caso de los productos para nutrición enteral domiciliaria, el nombre no deberá sugerir otras vías de administración diferentes a la sonda enteral ni hacer referencia a alimentos de consumo ordinario.
2 Marcar la/s opción/es que correspondan: Se entiende por lactante, al menor de 12 meses; niño, hasta 12 años inclusive; adulto, mayores de 12 años.
3 Indicar rango de edad, señalando el tramo de edad (mínima y máxima) para el que está indicado el producto.
4 Marcar la opción que corresponda. Los productos para nutrición enteral domiciliaria sólo serán financiables si son para administración por sonda o mixta (oral y sonda), debiendo reflejarse la vía de administración en el etiquetado.
5 Marcar la opción que corresponda. Los productos para nutrición enteral domiciliaria deberán presentarse en forma de líquido o polvo. En el caso de los productos que se presenten en forma de polvo, deberán pasar directamente a líquido por la adición de agua, debiendo garantizar el preparado final el aporte nutricional adecuado. Por tanto, no pueden ser de textura crema, puré, pudín, etc.
6 Expresada en gramos de producto por 100 mililitros de disolvente.
7 Expresada en kilocalorías por mililitro de producto (para productos en polvo se referirá a densidad calórica de la solución estándar). En el caso de las fórmulas para nutrición enteral domiciliaria el producto final preparado deberá tener una densidad calórica de 0,5 a 2,1 kilocalorías por mililitro.
8 Expresada en miliosmoles por litro de disolución.
9 Expresada en miliosmoles por litro de disolvente.
10 Expresado en daltons. Cumplimentar en el caso de las fórmulas con hidrolizados de proteínas.
11 Expresado en gramos de fibra por 100 mililitros. En el caso de los productos que se presenten en forma de polvo, la cantidad de fibra se referirá a 100 mililitros de la solución estándar.
12 Código del tipo y subtipo de producto dietético que propone la empresa entre los incluidos en el anexo I del Real Decreto 1205/2010, de 24 de septiembre, por el que se fijan las bases para la inclusión de los alimentos dietéticos para usos médicos especiales en la prestación con productos dietéticos del Sistema Nacional de Salud y el establecimiento de sus importes máximos de financiación.
13 Reflejar para qué patologías y situaciones clínicas, de las recogidas en el anexo VII del Real Decreto 1030/2006, de 15 de septiembre, por el que se establece la cartera de servicios comunes del Sistema Nacional de Salud y el procedimiento para su actualización, estaría indicado el producto.
14 Cada ficha está prevista para un máximo de cuatro presentaciones. En caso de que el producto tenga más de cuatro presentaciones se cumplimentarán tantas fichas como sean precisas para recoger todas las presentaciones ofertadas.
15 Todos los envases de una misma presentación (unidad de venta) han de tener el mismo sabor.
16 Precio de cada unidad de venta del producto sin impuestos ni márgenes de distribución que propone la empresa al Sistema Nacional de Salud.
Nombre del producto: ..................................................................................................
N.º de registro del producto: ...........................................................................................
Con motivo de los siguientes cambios en el citado producto (reflejar todos los motivos que dan lugar a la alteración de la Oferta, ej. Modificación de composición, nombre, formato, etc.) ..............................................................................................
y considerando que una vez efectuados los cambios citados, el producto sigue cumpliendo las condiciones establecidas en la normativa vigente reguladora de la prestación con productos dietéticos,
Solicito: La alteración de la Oferta y, si procede, la asignación de nuevo código identificativo o nuevo tipo o subtipo.
Para ello se acompaña:
|
– Breve2 explicación justificativa de los cambios producidos. |
|
– Etiqueta original de cada presentación. |
|
– Ficha de datos técnicos (en esta ficha se reflejará la nueva información de las diferentes presentaciones de acuerdo con la alteración de la oferta del producto que se solicita). |
|
– Boceto de nuevo precinto identificativo extraíble (tras la notificación de la resolución de aceptación de la alteración de la oferta se remitirá el precinto definitivo, previamente a su puesta en el mercado). |
|
– Justificante de haber pagado las tasas señaladas en el art. 32 de la Ley 53/2002, de 30 de diciembre, de Medidas Fiscales, Administrativas y del Orden Social (Modelo 791 – código 607). |
Fecha y firma
Fdo.:
Como: …………………………… de la empresa ……………………..............................
Subdirección General de Gestión de Riesgos Alimentarios.- Agencia Española de Seguridad Alimentaria y Nutrición. Ministerio de Sanidad, Política Social e Igualdad.
1 Se cumplimentará un único modelo de solicitud de alteración de la Oferta para todas aquellas presentaciones de un mismo número de registro sanitario que presenten el mismo tipo de alteración.
2 Que no exceda de 4 hojas DIN A4.
Nota: Presentar por duplicado.
Ficha de nuevos datos técnicos de las diferentes presentaciones del alimento dietético destinado a usos médicos especiales para el que se solicita la alteración de la Oferta

(Reverso de la Ficha de nuevos datos técnicos)
1 El nombre que se proponga deberá ser un nombre de fantasía o bien una denominación genérica acompañada de una marca comercial o del nombre del titular o fabricante del producto.
No deberá ser un nombre igual o similar al de otros productos dietéticos financiables o no financiables, medicamentos o productos sanitarios, de forma que su prescripción y dispensación no induzca a confusión respecto a otros productos de la misma u otra empresa. Asimismo el nombre no deberá llevar a error respecto a sus indicaciones. Además, en el caso de los productos para nutrición enteral domiciliaria, el nombre no deberá sugerir otras vías de administración diferentes a la sonda enteral ni hacer referencia a alimentos de consumo ordinario.
2 Marcar la/s opción/es que correspondan: Se entiende por lactante, al menor de 12 meses; niño, hasta 12 años inclusive; adulto, mayores de 12 años.
3 Indicar rango de edad, señalando el tramo de edad (mínima y máxima) para el que está indicado el producto.
4 Marcar la opción que corresponda. Los productos para nutrición enteral domiciliaria sólo serán financiables si son para administración por sonda o mixta (oral y sonda), debiendo reflejarse la vía de administración en el etiquetado.
5 Marcar la opción que corresponda. Los productos para nutrición enteral domiciliaria deberán presentarse en forma de líquido o polvo. En el caso de los productos que se presenten en forma de polvo, deberán pasar directamente a líquido por la adición de agua, debiendo garantizar el preparado final el aporte nutricional adecuado. Por tanto, no pueden ser de textura crema, puré, pudín, etc.
6 Expresado en gramos de producto por 100 mililitros de disolvente.
7 Expresada en kilocalorías por mililitro de producto (para productos en polvo se referirá a la densidad calórica de la solución estándar). En el caso de las fórmulas para nutrición enteral domiciliaria el producto final preparado deberá tener una densidad calórica de 0,5 a 2,1 kilocalorías por mililitro.
8 Se expresará en miliosmoles por litro de disolución.
9 Se expresará en miliosmoles por litro de disolvente.
10 Expresado en daltons. Cumplimentar en el caso de las fórmulas con hidrolizados de proteínas.
11 Expresado en gramos de fibra por 100 mililitros. En el caso de los productos que se presenten en forma de polvo, la cantidad de fibra se referirá a 100 mililitros de la solución estándar.
12 Código del tipo y subtipo de producto dietético que propone la empresa entre los incluidos en el anexo I del Real Decreto 1205/2010, de 24 de septiembre, por el que se fijan las bases para la inclusión de los alimentos dietéticos para usos médicos especiales en la prestación con productos dietéticos del Sistema Nacional de Salud y el establecimiento de sus importes máximos de financiación. Para aquellos productos que estén indicados tanto para niños como para adultos se clasificarán en el subtipo correspondiente a adultos.
13 Reflejar para qué patologías y situaciones clínicas, de las recogidas en el anexo VII del Real Decreto 1030/2006, de 15 de septiembre, por el que se establece la cartera de servicios comunes del Sistema Nacional de Salud y el procedimiento para su actualización, estaría indicado el producto.
14 Cada ficha está prevista para un máximo de cuatro presentaciones. En caso de que el producto tenga más de cuatro presentaciones se cumplimentarán tantas fichas como sean precisas para recoger todas las presentaciones ofertadas.
15 Código identificativo de las presentaciones para las que se solicita la alteración de la Oferta.
16 Todos los envases de una misma presentación (unidad de venta) han de tener el mismo sabor.
17 Precio de cada unidad de venta del producto sin impuestos ni márgenes de distribución que propone la empresa al Sistema Nacional de Salud.

(Reverso del anexo IV: Modelo de comunicación de suspensión temporal de comercialización o de baja en la Oferta)
1 Márquese lo que proceda.
2 Se comunicará con antelación a que se produzca la suspensión temporal de acuerdo con lo recogido en el apartado 4 del artículo 9 de la Orden SIP/ /2010/, de de , por la que se establece el procedimiento para la inclusión de los alimentos dietéticos para usos médicos especiales en la Oferta de productos dietéticos del Sistema Nacional de Salud y para la aplicación de los importes máximos de financiación.
3 Se comunicará con una antelación mínima de tres meses de acuerdo con lo recogido en el apartado 5 del artículo 9 de la Orden SIP/ /2010/, de de , por la que se establece el procedimiento para la inclusión de los alimentos dietéticos para usos médicos especiales en la Oferta de productos dietéticos del Sistema Nacional de Salud y para la aplicación de los importes máximos de financiación.
4 Se consignarán todas las presentaciones del producto cuya suspensión temporal o baja se comunica.

(Reverso de la Ficha de remisión de los precios de venta de la empresa propuestos)
Para la cumplimentación del anexo V se tendrán en cuenta lo siguiente:
1 La empresa remitirá, en un envío único, la relación de todos sus productos, incluidos en la Oferta a la fecha de entrada en vigor de la Orden, de acuerdo con lo establecido en la disposición transitoria primera, ordenados de forma ascendente por número de registro y para cada número de registro por orden ascendente del código identificativo de cada presentación. En el caso de aquellas presentaciones que no se consignen, se entenderá que la empresa renuncia a que sean susceptibles de financiación por el SNS, y en tal caso, se procederá a la supresión de la correspondiente inscripción de dicha presentación en la Oferta.
La relación de productos irá acompañada de la ficha de información adjunta para cada una de las presentaciones de cada producto junto con el etiquetado autorizado de cada presentación.
2 Reflejar si la empresa considera que las presentaciones de los productos que se relacionan cumplen los requisitos establecidos por la normativa vigente sobre prestación con productos dietéticos o no.
3 En el caso que la empresa considere que alguna presentación incumple algún requisito de la normativa vigente, pero desee adaptarla a la misma se hará constar en el epígrafe destinado al efecto del citado anexo V, consignando la/s letra/s correspondiente/s al/a los motivo/s por el/los que no se cumple la normativa vigente sobre prestación con productos dietéticos:
a) No está indicado para las patologías y situaciones clínicas que se recogen en el anexo VII del RD 1030/2006.
b) No pertenece a alguno de los tipos y subtipos recogidos en el anexo I del Real Decreto 1205/2010, de 24 de septiembre, por el que se fijan las bases para la inclusión de los alimentos dietéticos para usos médicos especiales en la prestación con productos dietéticos del Sistema Nacional de Salud y para el establecimiento de sus importes máximos de financiación.
c) No se ajusta su presentación (tipo de envase y tamaño) y composición a los requerimientos nutricionales de los pacientes en las indicaciones y situaciones clínicas financiadas a las que van destinados.
d) Se presenta en forma de cápsulas, comprimidos, tabletas, u otras formas similares a las de medicamentos.
e) No refleja claramente en el etiquetado las indicaciones para las que se financia el producto o incluye frases, dibujos u otros motivos gráficos que llevan a confusión respecto a las indicaciones financiables, o contiene alusiones a otros productos.
f) Tiene un nombre igual o similar al de otros productos dietéticos financiables o no financiables, medicamentos o productos sanitarios.
g) Tiene indicaciones exclusivamente para pacientes hospitalizados en régimen de internamiento.
Además, en el caso de las fórmulas para nutrición enteral domiciliaria:
h) El nombre sugiere otras vías de administración diferentes a la sonda enteral o hace referencia a alimentos de consumo ordinario.
i) No es una dieta completa, constituida por una mezcla definida de macro y micronutrientes, en cantidad y distribución adecuadas para utilizarse como única fuente nutricional.
j) No está destinada a ser administrada por sonda enteral (nasogástrica u ostomía).
k) No tiene una densidad calórica de 0,5 a 2,1 kcal/ml en el producto final preparado.
l) No se presenta en forma de líquido o polvo. En el caso de que se presente en forma de polvo, no pasa directamente a líquido por la adición de agua, o el preparado final a la solución estándar no garantiza el aporte nutricional adecuado.
m) Es un suplemento nutricional.
n) Se ha obtenido total o parcialmente por deshidratación o trituración directa de alimentos, o por mezcla de alimentos, de consumo ordinario, simples o elaborados, o lleva algún ingrediente natural (pueden llevar aceites como fuente de lípidos o ingredientes naturales con la finalidad exclusiva de saborizar el producto hasta un tope máximo de un 2% del contenido total del producto).
o) Tiene una composición o características similares a las de un medicamento.
p) Su nombre hace alusión a vías de administración diferentes a las de sonda.
q) Otros (especifíquese).
Ficha de información para cada una de las presentaciones de alimentos dietéticos para usos médicos especiales incluidos en la Oferta1

(reverso de la Ficha)
1 Se cumplimentará una ficha por cada una de las presentaciones relacionadas en el anexo V que irá acompañada del etiquetado autorizado de cada presentación. Se presentarán en el mismo orden que la relación del anexo V, es decir, por número de registro ascendente y para cada número de registro por orden ascendente del código identificativo de cada presentación.
2 Propuesta de subtipo correspondiente a cada producto de los incluidos como anexo I Real Decreto 1205/2010, de 24 de septiembre, por el que se fijan las bases para la inclusión de los alimentos dietéticos para usos médicos especiales en la prestación con productos dietéticos del Sistema Nacional de Salud y para el establecimiento de sus importes máximos de financiación.
3 Precio de venta de la empresa propuesto (sin IVA). Este importe no podrá ser superior al importe máximo de financiación que se obtiene de aplicar a cada producto el valor del indicador de referencia del correspondiente subtipo, recogido en el anexo III del Real Decreto 1205/2010, de 24 de septiembre, de acuerdo con la fórmula del anexo IV de dicho real decreto. En el caso de presentaciones que vayan a aplicar los importes máximos en dos etapas, será el precio de oferta final que se aplicará en la segunda etapa.
4 Cumplimentar únicamente para los productos para los que se solicita que la aplicación de los importes máximos se realice en dos etapas. Esta solicitud se podrá efectuar para aquellos productos que la adecuación al importe máximo de financiación correspondiente a su subtipo les suponga una reducción superior al 10 % de su precio de venta de empresa sin IVA del año 2010 facilitado al Ministerio de Sanidad, Política Social e Igualdad. En la primera etapa, a los diez meses de la entrada en vigor de esta norma, el producto se financiará al importe propuesto resultante de reducir como mínimo un 10 % el precio de venta de la empresa, y la segunda, una vez transcurridos los seis meses siguientes, al precio de oferta.
5 Marcar la/s opción/es que correspondan: Se entiende por lactante, al menor de 12 meses; niño, hasta 12 años inclusive, independientemente de que el producto pueda estar indicado además en menores de 12 meses; adulto, mayores de 12 años, aunque pueda estar además indicado en menores de esa edad.
6 Indicar rango de edad, señalando el tramo de edad (mínima y máxima) para el que está indicado el producto.
7 Expresada en kilocalorías por mililitro de producto (para productos en polvo se referirá a la densidad calórica de la solución estándar). En el caso de las fórmulas para nutrición enteral domiciliaria el producto final preparado deberá tener una densidad calórica de 0,5 a 2,1 kilocalorías por mililitro.
8 CI: Contenido total de la unidad de venta referido a cada indicador de referencia (total de kilocalorías, proteínas, aminoácidos, etc.) que multiplicado por el valor del indicador (VI) de referencia del subtipo correspondiente expresado en euros, permite calcular el importe máximo de financiación (IMF) mediante la siguiente fórmula: IMF= VI x CI.
9 Expresado en gramos por 100 mililitros. En el caso de los productos que se presenten en forma de polvo, la cantidad se referirá a 100 gramos de producto.
10 El componente proteico se expresará en gramos de equivalente proteico en los casos que proceda.
Agencia Estatal Boletín Oficial del Estado
Avda. de Manoteras, 54 - 28050 Madrid