El Real Decreto 1035/1999, de 18 de junio, por el que se regula el sistema de precios de referencia en la financiación de medicamentos con cargo a fondos de la Seguridad Social o a fondos estatales afectos a la sanidad, desarrolla lo previsto en el artículo 94.6 de la Ley 25/1990, de 20 de diciembre, del Medicamento, en la redacción que, sucesivamente, dan al mismo la Ley 13/1996, de 30 de diciembre, y la Ley 66/1997, de 30 de diciembre, ambas de Medidas Fiscales, Administrativas y del Orden Social.
El artículo 1 del mencionado Real Decreto dispone que el sistema de precios de referencia quedará referido a las presentaciones de especialidades farmacéuticas que se incluyan en los conjuntos homogéneos que se determinen por la Ministra de Sanidad y Consumo. A su vez, el artículo 3.1 de dicha norma establece que la Ministra de Sanidad y Consumo, previo Acuerdo de la Comisión Delegada del Gobierno para Asuntos Económicos, aprobará los precios de referencia aplicables a cada uno de los conjuntos homogéneos citados y, con periodicidad mínima anual, los correspondientes a nuevos conjuntos homogéneos que se puedan crear por haberse comercializado, desde el último Acuerdo del mencionado órgano colegiado, presentaciones previamente inexistentes de especialidades farmacéuticas genéricas.
Asimismo, el artículo 3.3 del citado Real Decreto 1035/1999 prevé que, también previo Acuerdo de la Comisión Delegada del Gobierno para Asuntos Económicos, la Ministra de Sanidad y Consumo podrá revisar, a condición de que se respete la vigencia mínima de un año, los precios de referencia teniendo en cuenta los criterios establecidos en el artículo 2 de la misma norma.
Por otra parte, el artículo 2 del Real Decreto-ley 12/1999, de 31 de julio, de Medidas urgentes para la contención del gasto farmacéutico en el Sistema Nacional de Salud, establece que cuando el precio de las presentaciones de especialidades farmacéuticas no bioequivalentes utilizadas para el cálculo del precio de referencia supere éste, se reducirá aquél hasta la cuantía fijada para el de referencia.
Con base en lo previsto por las mencionadas disposiciones, procede cumplimentar formalmente los citados mandatos determinando, una vez efectuada por la Directora de la Agencia Española del Medicamento la correspondiente calificación de bioequivalencia, los nuevos conjuntos homogéneos relativos a presentaciones de especialidades farmacéuticas genéricas comercializadas desde el último Acuerdo de la Comisión Delegada del Gobierno para Asuntos Económicos; aprobando, tras el preceptivo Acuerdo de la citada Comisión Delegada, en reunión celebrada el día 20 de diciembre de 2001, los precios de referencia correspondientes a dichos nuevos conjuntos; y revisando, también previa decisión de dicho órgano colegiado adoptada en la misma fecha, los precios de referencia aprobados mediante Orden de la Ministra de Sanidad y Consumo, de 13 de julio de 2000, y relativos a los conjuntos homogéneos que fueron determinados a través de la misma norma.
En virtud de lo anterior, dispongo:
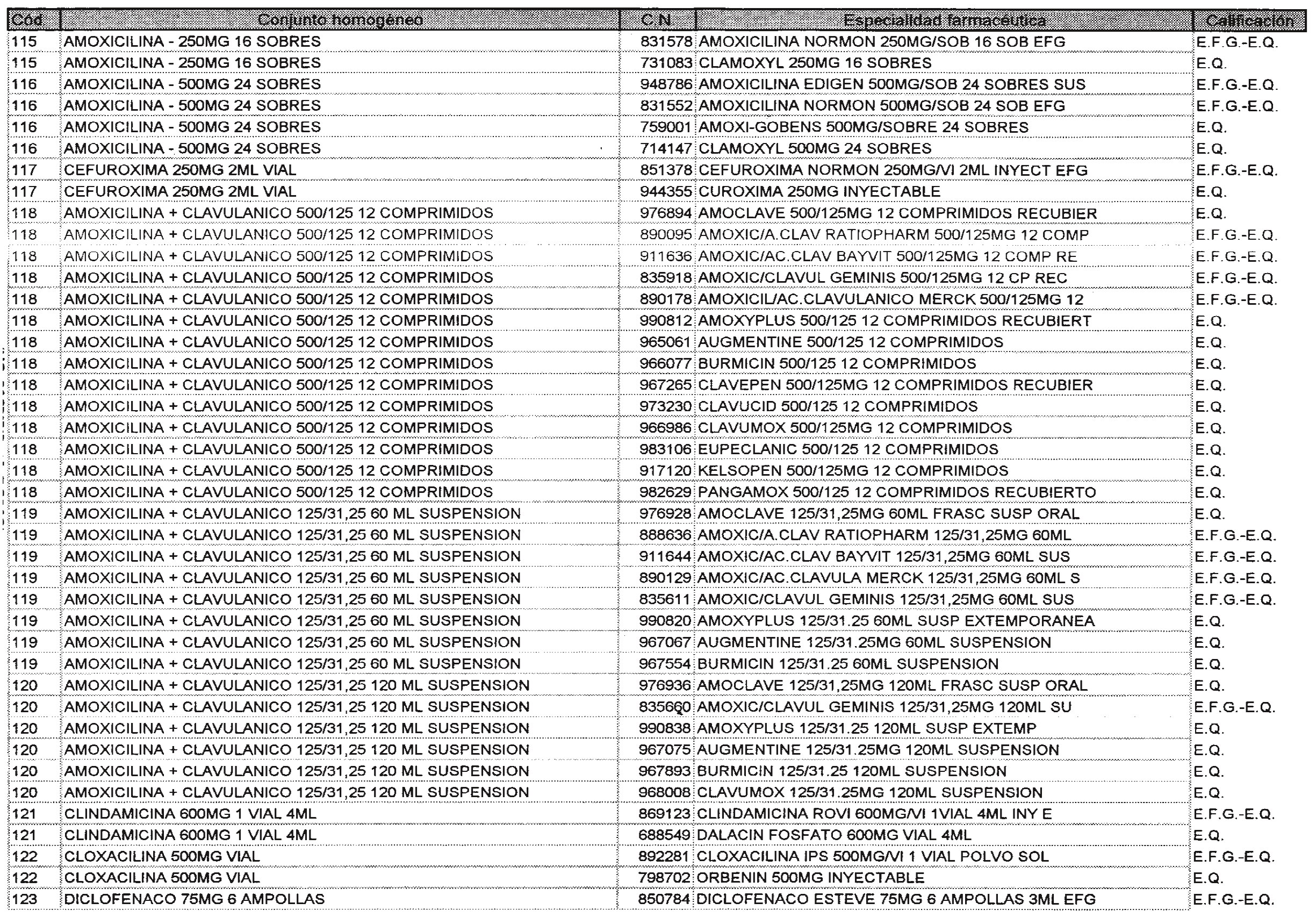
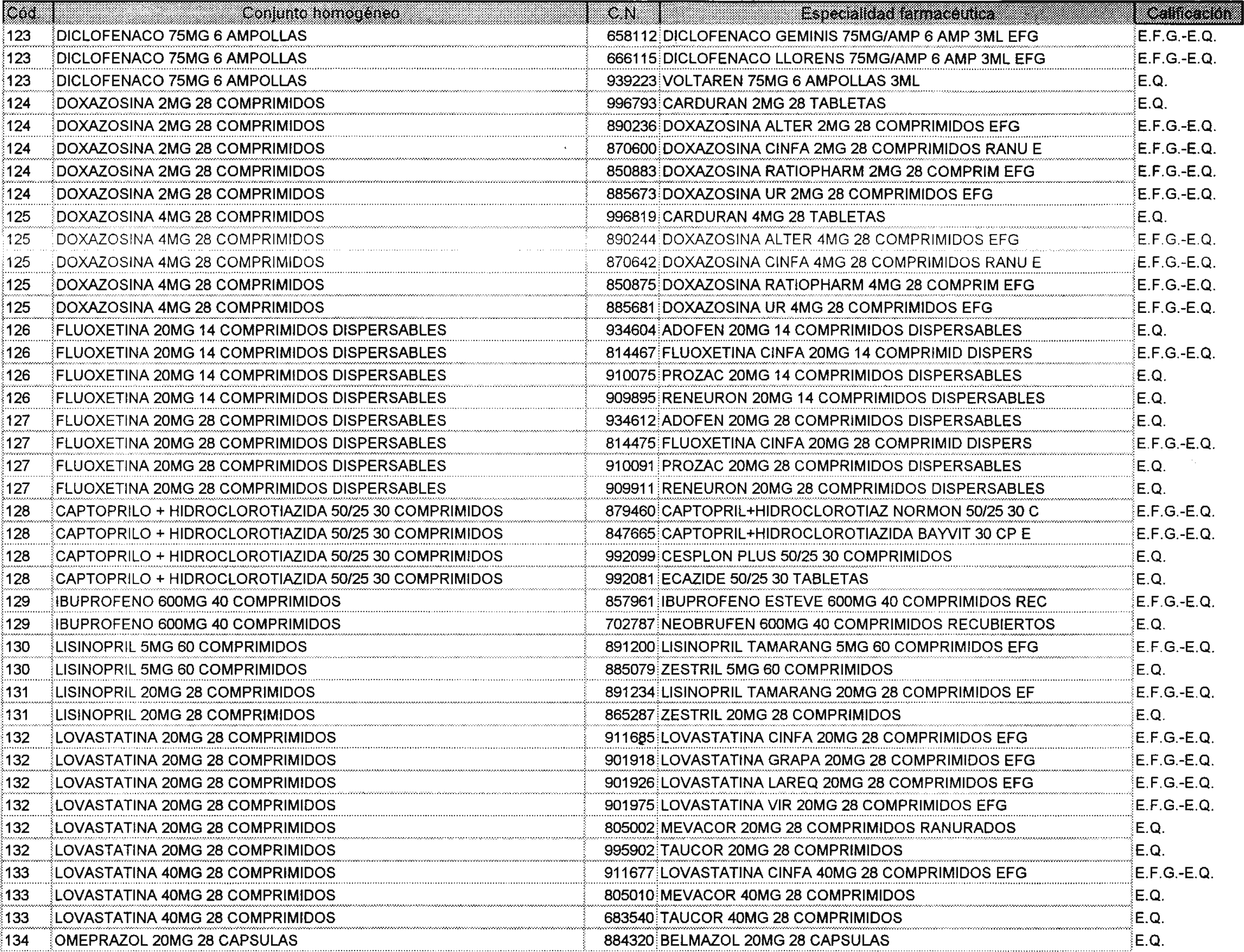
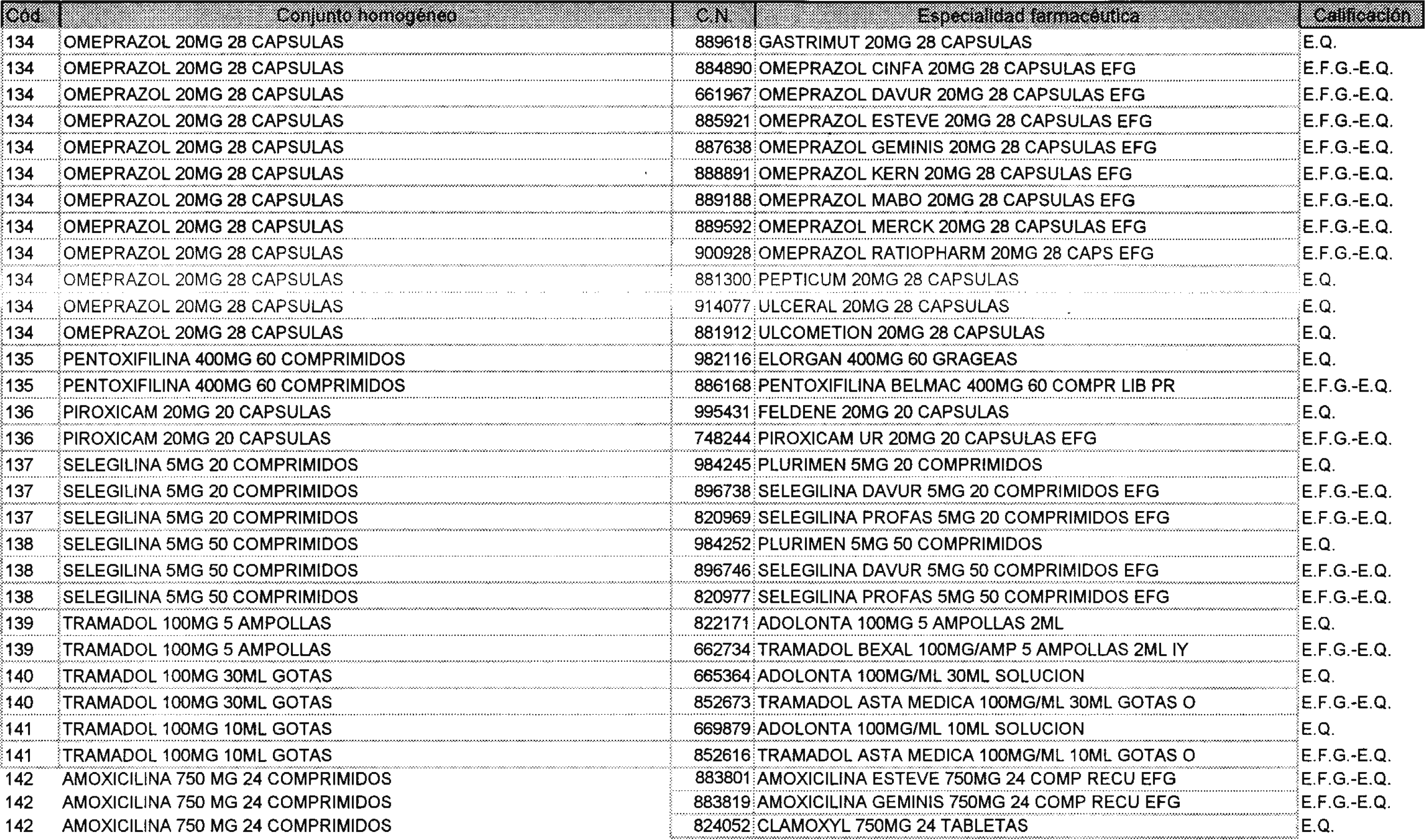
Los nuevos conjuntos homogéneos, creados conforme a lo previsto por el artículo 1 del Real Decreto 1035/1999, son los que se determinan por la presente Orden y se relacionan en el anexo I de la misma.
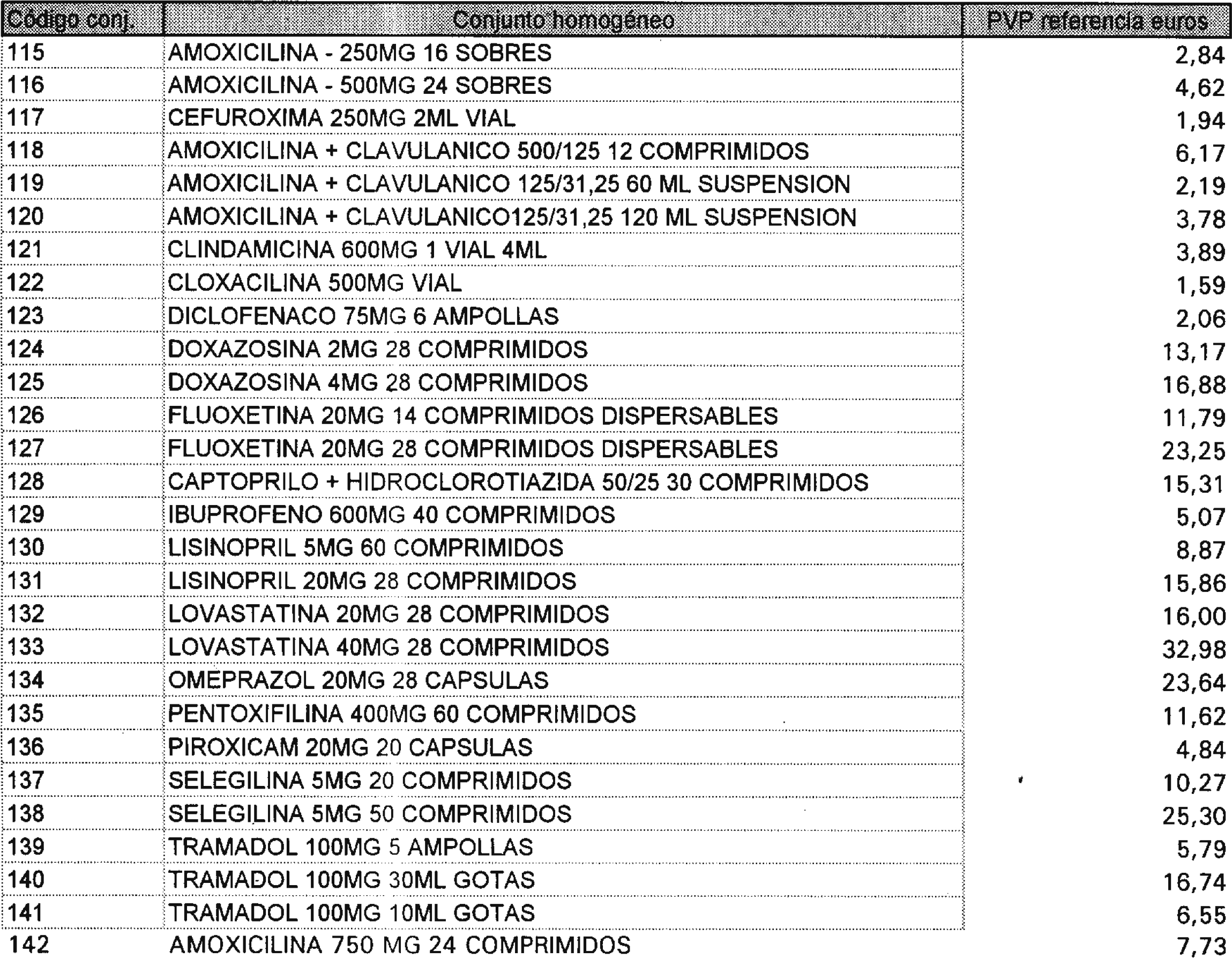
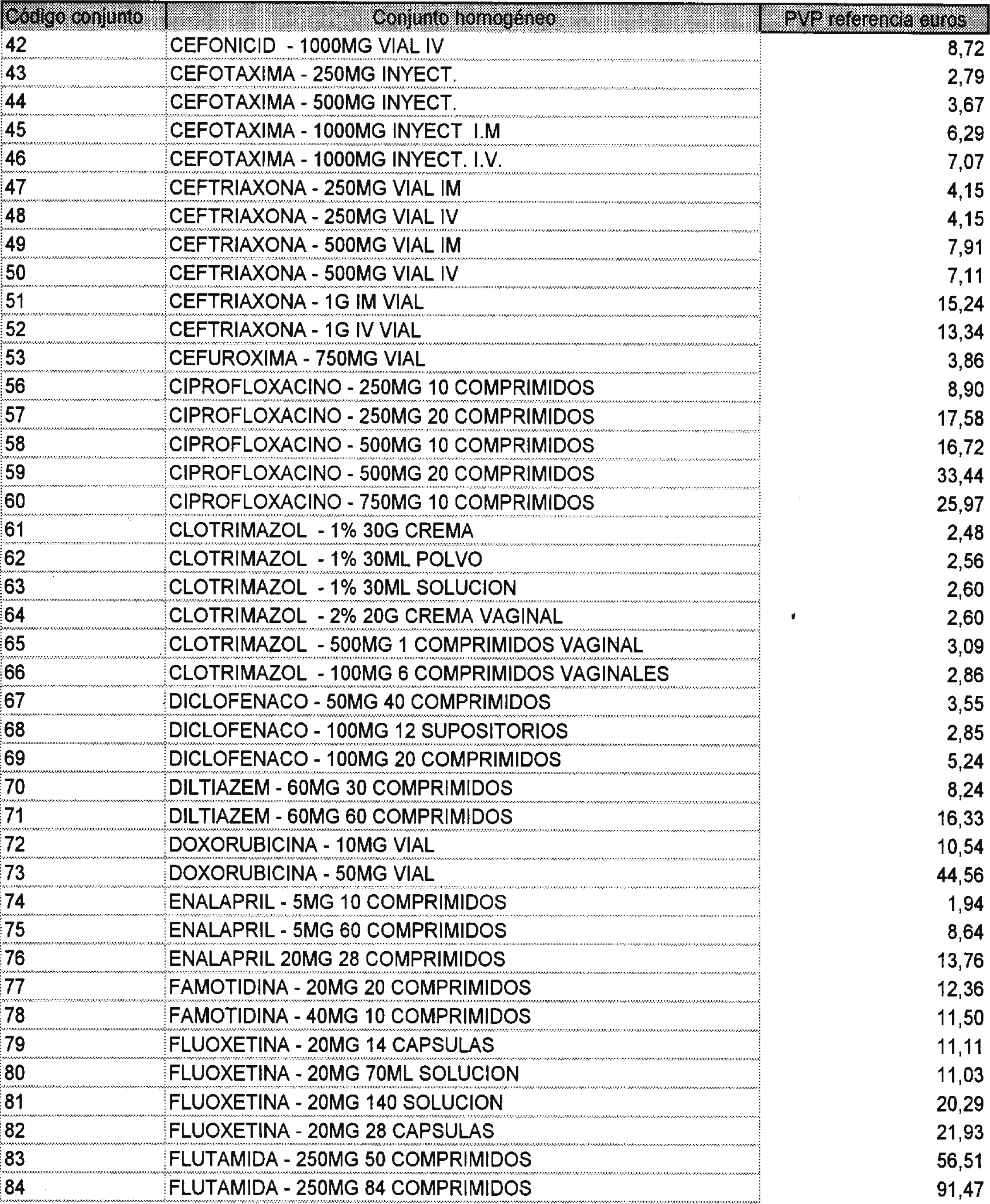
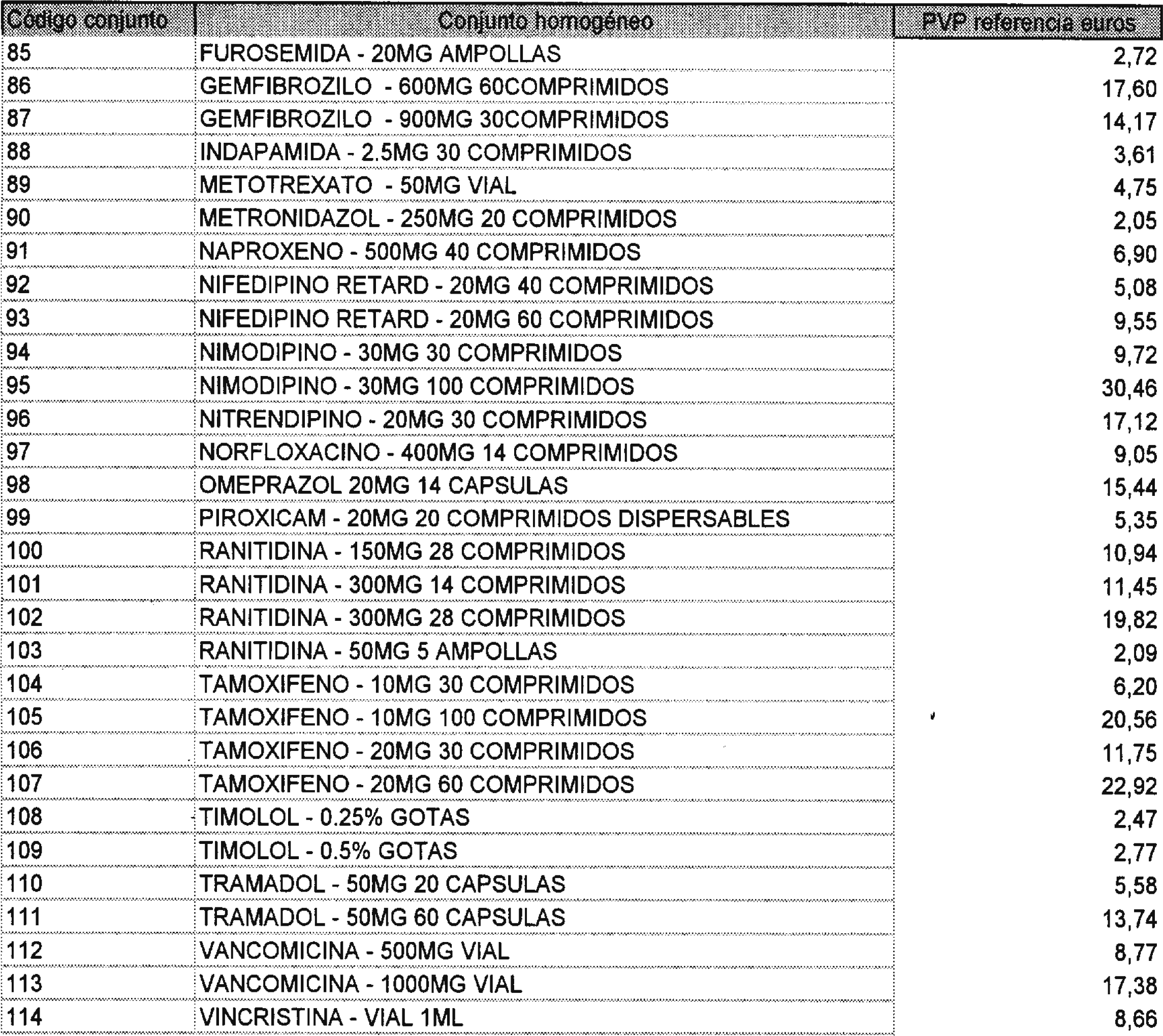
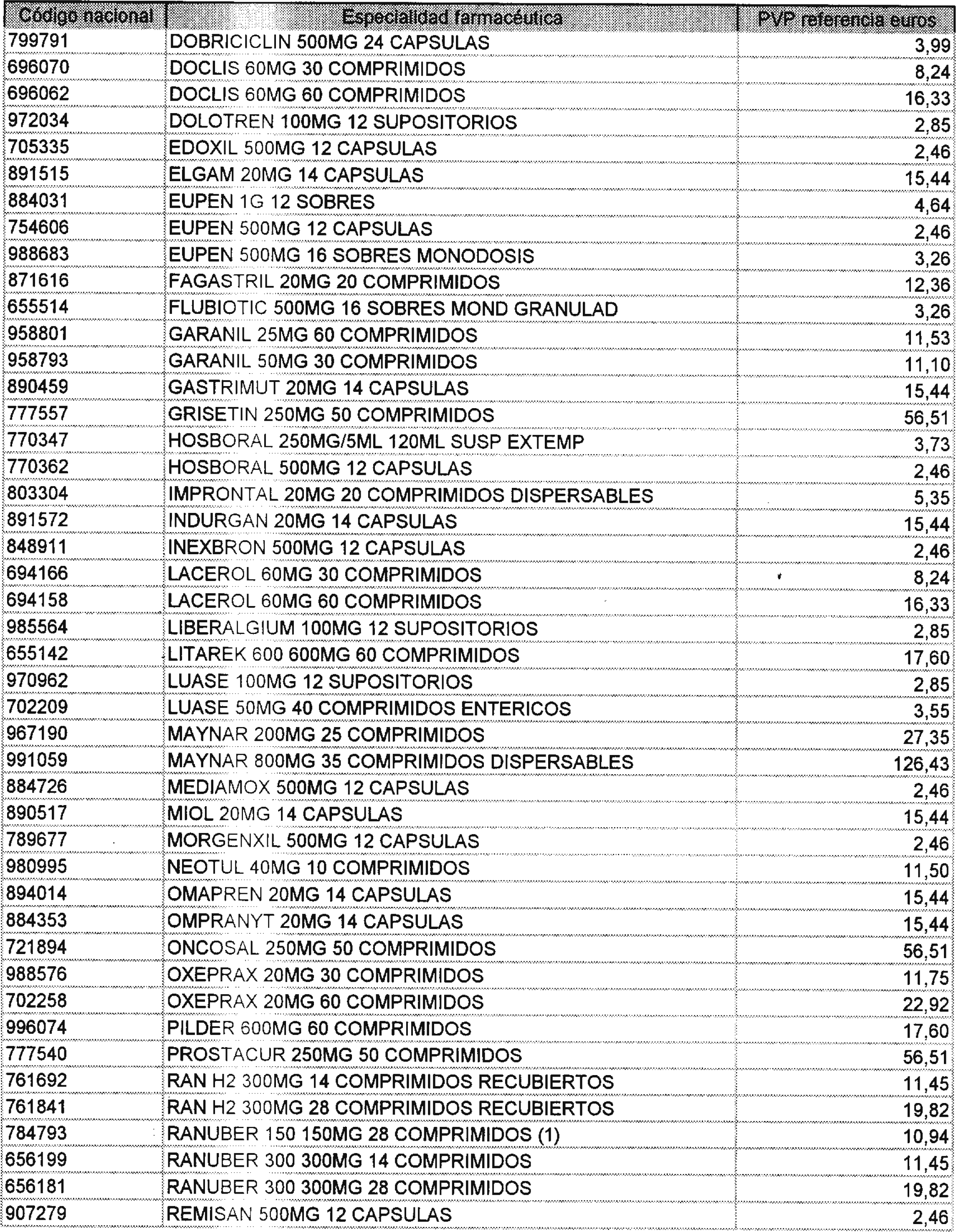
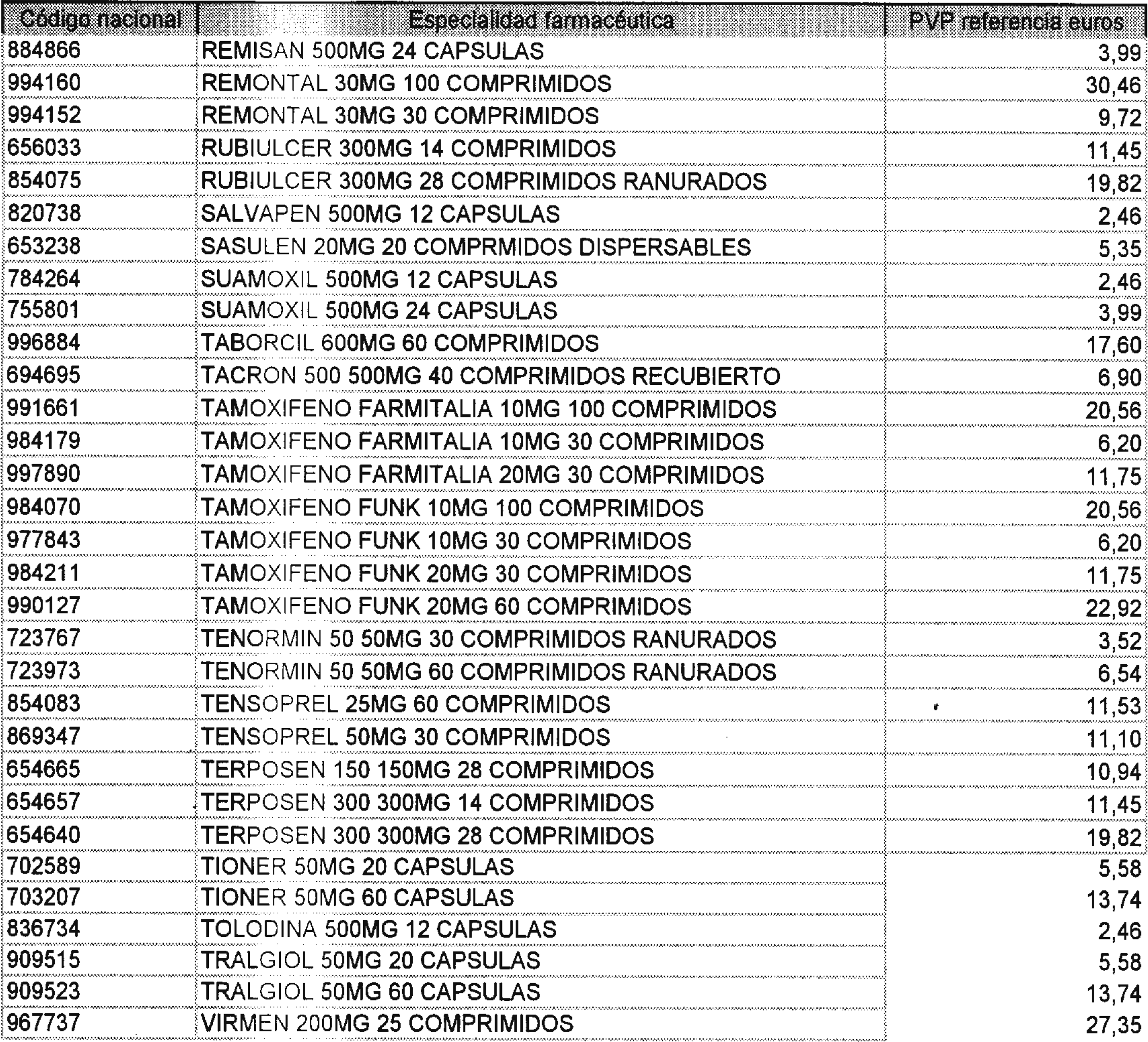
Los precios de referencia aplicables a cada uno de los conjuntos homogéneos a que se refiere el punto anterior, son los que se aprueban por la presente Orden y se relacionan en el anexo II de la misma.
Los precios de referencia aprobados por Orden ministerial, de 13 de julio de 2000, revisados, conforme a lo previsto por el artículo 3.3 del Real Decreto 1035/1999, son los que se relacionan en el anexo IV de esta Orden.
En el plazo de tres meses desde la fecha de entrada en vigor de la presente Orden, los laboratorios cumplimentarán, en sus instalaciones centrales, la exigencia de incorporación de la sigla EQ en el cupón precinto correspondiente a las especialidades farmacéuticas a las que se refiere el anexo I, bien utilizando nuevos cartonajes, bien reetiquetando los actuales con etiquetas adhesivas.
Transcurrido el plazo de tres meses desde la fecha de entrada en vigor de la presente Orden, los laboratorios únicamente suministrarán a los almacenes de distribución y a las Oficinas de farmacia especialidades farmacéuticas con la sigla EQ en el cupón precinto en los términos previstos en el párrafo anterior.
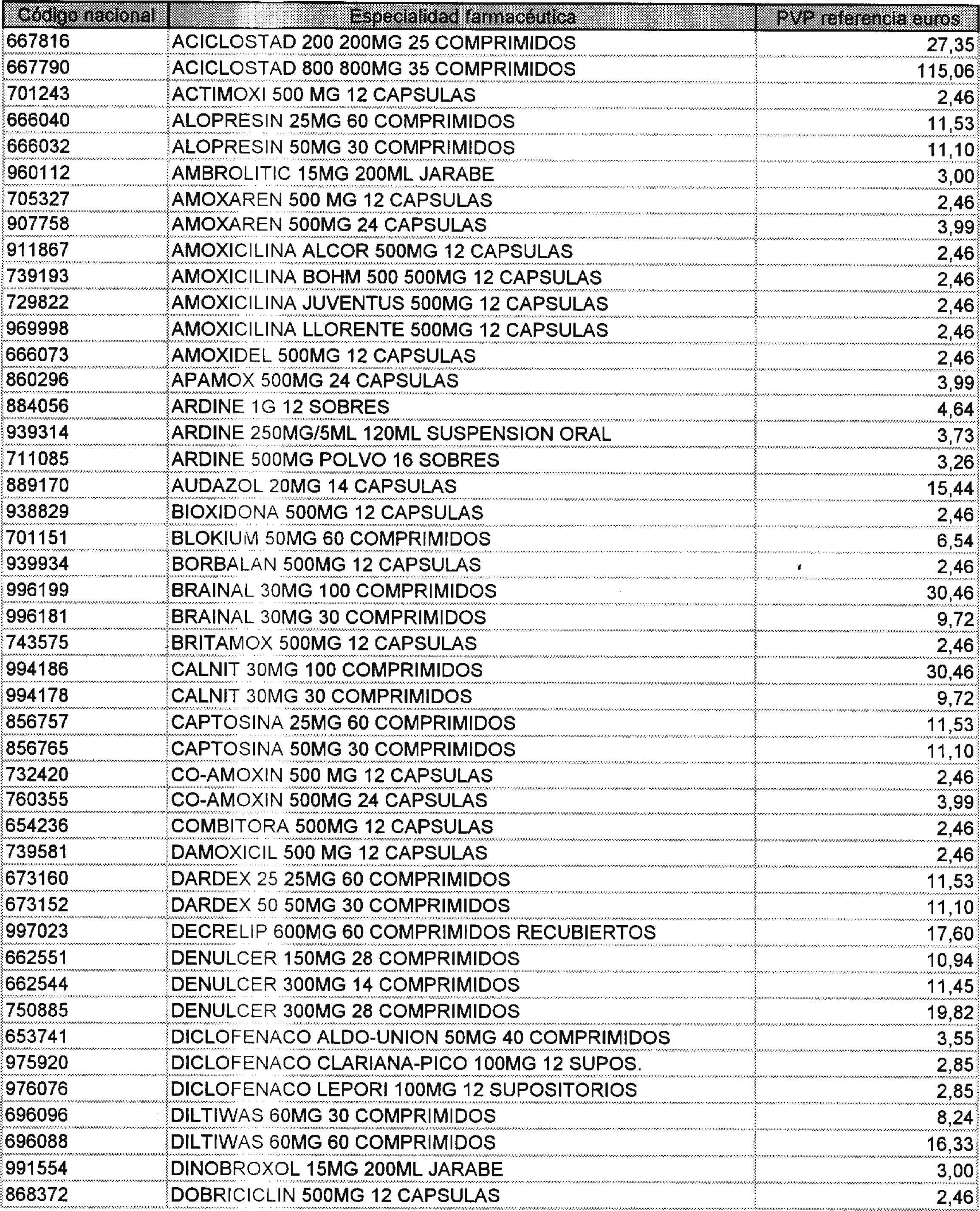
En el plazo de tres meses desde la fecha de entrada en vigor de la presente Orden, las presentaciones de especialidades farmacéuticas no calificadas como bioequivalentes, que hayan sido utilizadas para la determinación de la cuota de mercado y el cálculo de los precios de referencia y su precio sea superior a éste, que se relacionan en el anexo III de esta Orden, se suministrarán por los laboratorios al precio industrial que se corresponda con el de referencia.
Los laboratorios cumplimentarán, en sus instalaciones centrales, las modificaciones en el cartonaje que se deriven de la exigencia a la que se refiere el párrafo anterior, bien utilizando nuevos cartonajes, bien reetiquetando los actuales con etiquetas adhesivas. No se modificará el Código nacional de la especialidad.
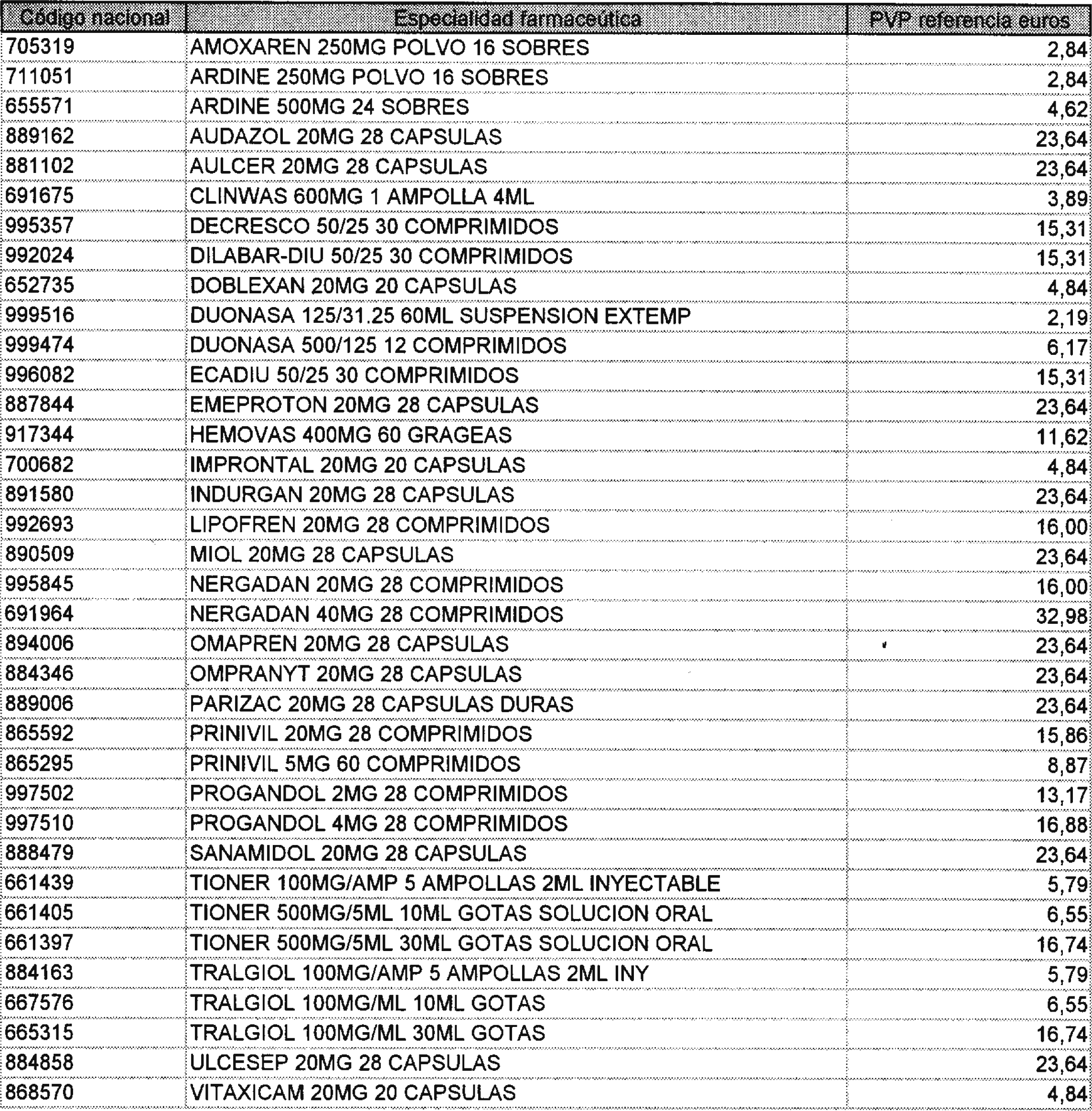
Lo establecido en los párrafos anteriores será asimismo de aplicación a las presentaciones de especialidades farmacéuticas no calificadas como bioequivalentes, cuyo precio sea superior al de referencia revisado en la presente Orden y que se relacionan en el anexo V de la misma.
Los laboratorios que voluntariamente decidan comercializar las presentaciones de especialidades farmacéuticas a un precio inferior al autorizado para adecuarlo a un nivel igual o inferior al de referencia, sin modificar el Código nacional, deberán comunicarlo al Ministerio de Sanidad y Consumo en el plazo de treinta días a partir de la fecha de entrada en vigor de la presente Orden.
Lo establecido en el párrafo anterior será asimismo de aplicación a las presentaciones de especialidades farmacéuticas cuyo precio sea superior al de referencia revisado en la presente Orden.
Las presentaciones de especialidades farmacéuticas a que se refiere la disposición adicional tercera se suministrarán por los laboratorios con el nuevo precio en el plazo de tres meses desde la fecha de entrada en vigor de la presente Orden. Los laboratorios no modificarán el Código nacional de la especialidad farmacéutica y cumplimentarán los cambios del cartonaje en la forma indicada en el párrafo segundo de la disposición adicional segunda.
Sin perjuicio de que las Oficinas de farmacia dispongan de existencias con precios anteriores y posteriores a las reducciones establecidas en las disposiciones adicionales segunda y tercera de la presente Orden, las cantidades que en cada caso correspondan serán satisfechas con base en el precio fijado en el embalaje exterior. No obstante lo anterior, en el ámbito del Sistema Nacional de Salud, así como en los Regímenes Especiales de la Mutualidad General de Funcionarios Civiles del Estado (MUFACE), del Instituto Social de las Fuerzas Armadas (ISFAS) y de la Mutualidad General Judicial (MUGEJU), las cantidades satisfechas por el beneficiario se calcularán con base en los nuevos precios.
Las obligaciones a las que se refieren las disposiciones adicionales primera y segunda de la Orden de la Ministra de Sanidad y Consumo de 13 de julio de 2000 continúan vigentes a todos los efectos. Las obligaciones contenidas en la disposición adicional octava de dicha Orden serán efectivas, por lo que se refiere a las especialidades afectadas por la presente Orden, a partir del 1 de mayo de 2002.
El Sistema Nacional de Salud, así como MUFACE, ISFAS Y MUGEJU, mantendrán, hasta el día 30 de abril de 2002, el precio anterior de las especialidades afectadas por lo establecido en las disposiciones adicionales segunda y tercera de esta Orden, a efectos de facturación y en lo que se refiere, exclusivamente, a la parte del gasto satisfecho directamente por dicho Sistema y por los Regímenes Especiales mencionados. Las facturaciones cerradas a partir del día 1 de mayo de 2002 se liquidarán con los nuevos precios.
La presente Orden entrará en vigor el día siguiente al de su publicación en el «Boletín Oficial del Estado».
Madrid, 27 de diciembre de 2001.
VILLALOBOS TALERO

Agencia Estatal Boletín Oficial del Estado
Avda. de Manoteras, 54 - 28050 Madrid