 Este texto consolidado es de carácter informativo y no tiene valor jurídico.
Este texto consolidado es de carácter informativo y no tiene valor jurídico.Norma derogada, con efectos de 23 de marzo de 2023, por la disposición derogatoria única.1.a) del Real Decreto 192/2023, de 21 de marzo, Ref. BOE-A-2023-7416, con las siguientes excepciones:
1.º Los artículos 30, 31 y 32 y las obligaciones relativas a la vigilancia y las investigaciones clínicas previstas en los correspondientes anexos, que quedan derogados con efectos a partir de la fecha posterior de las mencionadas en el apartado 3.d) del artículo 123, del Reglamento (UE) 2017/745 del Parlamento Europeo y del Consejo, de 5 de abril de 2017.
2.º Los apartados 5 y 6 del artículo 19, los artículos 22, 23, 24 y 25 y la notificación de certificados previstas en los correspondientes anexos, que quedan derogados con efectos a partir de los dieciocho meses después de la fecha posterior de las mencionadas en el apartado 3.d) del artículo 123, del Reglamento (UE) 2017/745 del Parlamento Europeo y del Consejo, de 5 de abril de 2017.
3.º El articulo 33 relativo a las tarjetas de implantación mientras que los productos se sigan introduciendo en el mercado y comercializando de acuerdo a lo establecido en los apartados 3 y 4 del artículo 120 del Reglamento (UE) 2017/745 del Parlamento Europeo y del Consejo, de 5 de abril de 2017.
4.º El artículo 21 relativo al procedimiento del Organismo Notificado y los artículos 38, 39 y 40 relativos a la publicidad, promoción, incentivos y patrocinio de reuniones científicas que mantendrán su vigencia hasta el desarrollo de su legislación específica.
5.º La disposición adicional cuarta, relativa a la aplicación del capítulo VII del mencionado real decreto a los productos sanitarios para el diagnóstico in vitro, que mantendrán su vigencia hasta el desarrollo de su legislación específica.
La Ley 14/1986, de 25 de abril, General de Sanidad, en su artículo 40, apartados 5 y 6, atribuye a la Administración General del Estado competencias para la reglamentación, autorización, registro u homologación, según proceda, de los medicamentos de uso humano y veterinario y de los demás productos y artículos sanitarios y de aquellos que, al afectar al ser humano, puedan suponer un riesgo para la salud de las personas; así como para reglamentar y autorizar las actividades de quienes se dedican a la fabricación e importación de los citados productos.
A su vez, el artículo 110 de dicha ley le encomienda valorar la seguridad, eficacia y eficiencia de las tecnologías relevantes para la salud y la asistencia sanitaria.
Por otro lado, la Ley 29/2006, de 26 de julio, de garantías y uso racional de los medicamentos y productos sanitarios, incluye en su ámbito de aplicación a los productos sanitarios, estableciendo diversas previsiones en relación con estos productos que se desarrollan en este real decreto.
El Real Decreto 414/1996, de 1 de marzo, por el que se regula los productos sanitarios, ha constituido el marco reglamentario español para la fabricación, importación, certificación, puesta en el mercado, puesta en servicio, distribución, publicidad y utilización de los productos sanitarios. Esta regulación incorporó a nuestro derecho interno la Directiva 93/42/CEE del Consejo, de 14 de junio de 1993, relativa a los productos sanitarios, que constituye una directiva específica con arreglo al artículo 1, apartado 4, de la Directiva 2004/108/CE del Parlamento Europeo y del Consejo, de 15 de diciembre de 2004, relativa a la aproximación de las legislaciones de los Estados miembros en materia de compatibilidad electromagnética.
El citado Real Decreto 414/1996, de 1 de marzo, ha sido objeto durante su vigencia de diversas modificaciones con el fin de actualizarlo en consonancia con la experiencia adquirida durante su aplicación, así como de incorporar las novedades normativas consecuencia de las disposiciones comunitarias.
Con este real decreto se transpone la Directiva 2007/47/CE del Parlamento Europeo y del Consejo, de 5 de septiembre de 2007, por la que se modifica la Directiva 90/385/CEE del Consejo, relativa a la aproximación de las disposiciones de los Estados miembros sobre los productos sanitarios implantables activos, la Directiva 93/42/CEE del Consejo, relativa a los productos sanitarios y la Directiva 98/8/CE relativa a la comercialización de biocidas, incorporando asimismo en un único texto todas las modificaciones habidas hasta la fecha, facilitando con ello su aplicación.
Igualmente, se introducen determinados aspectos de otras disposiciones comunitarias recientes relevantes para el sector, en particular las relativas a las obligaciones de los agentes económicos y a los controles en frontera del Reglamento (CE) n.º 765/2008 del Parlamento Europeo y del Consejo, de 9 de julio de 2008, por el que se establecen los requisitos de acreditación y vigilancia del mercado relativos a la comercialización de los productos y por el que se deroga el Reglamento (CEE) n.º 339/93; y de la Decisión n.º 768/2008/CE del Parlamento Europeo y del Consejo, de 9 de julio de 2008, sobre un marco común para la comercialización de los productos y por la que se deroga la Decisión 93/465/CEE del Consejo.
La legislación de los productos sanitarios tiene como finalidad garantizar la libre circulación de éstos en el territorio comunitario, ofreciendo, a su vez, un nivel de protección elevado, de forma que los productos que circulen no presenten riesgos para la salud o seguridad de los pacientes, usuarios o terceras personas y alcancen las prestaciones asignadas por el fabricante, cuando se utilicen en las condiciones previstas.
Con este fin se establecen los requisitos esenciales que deben cumplir los productos, así como sus accesorios, incluyendo los programas informáticos que intervengan en su funcionamiento. La interpretación y aplicación de tales requisitos debe tener en cuenta el estado de la técnica, estando encaminadas a la mayor protección de la salud y la seguridad.
Los requisitos esenciales incorporan todos los aspectos que influyen en la seguridad de los productos, incluyendo los de compatibilidad electromagnética y protección de las radiaciones, así como los relativos al diseño ergonómico y al nivel de formación de los posibles usuarios. En ellos se incluyen los requisitos de aplicación particular a los productos que contienen derivados de tejidos animales, a los que contienen medicamentos como elemento auxiliar, y a los que incorporan derivados de la sangre humana. El cumplimiento de requisitos se ve facilitado mediante la referencia a normas europeas armonizadas, así como mediante la referencia a las correspondientes monografías de la Farmacopea Europea.
Atendiendo a los riesgos potenciales que pueden derivarse de su utilización, los productos sanitarios se agrupan en cuatro clases: I, IIa, IIb y III, aplicando las reglas de decisión que se basan en la vulnerabilidad del cuerpo humano. En función de estas clases, se aplican los diferentes procedimientos de evaluación de la conformidad, de manera que en los productos de menor riesgo, clase I, la evaluación se realiza bajo la exclusiva responsabilidad de los fabricantes, mientras que en el resto de las clases es necesaria la intervención de un organismo notificado. El grado de intervención y la profundidad de la evaluación están en consonancia con la clase de riesgo del producto, si bien siempre es necesario el examen de la documentación técnica relativa al diseño para que el organismo pueda verificar el cumplimiento del producto con los requisitos esenciales.
Los organismos notificados son designados por las autoridades nacionales, quienes ostentan la capacidad de supervisión sobre las actividades de dichos organismos, debiendo éstos facilitarles toda la información necesaria, incluida la relativa a los certificados emitidos, rechazados, suspendidos o retirados. Este real decreto detalla el procedimiento a seguir por el organismo notificado en sus actividades de certificación de la conformidad solicitadas por los fabricantes.
Como norma general, la evaluación de la conformidad de los productos requiere disponer de datos clínicos, siendo la investigación clínica una de las etapas cruciales en el desarrollo de nuevos productos o de nuevas aplicaciones, por ello se detallan las condiciones en que deben efectuarse estas investigaciones, su procedimiento de autorización y las informaciones que deben mantenerse, facilitarse o registrarse en los archivos y bases de datos correspondientes.
El Sistema de vigilancia de productos sanitarios constituye un elemento esencial, recibiendo y evaluando los incidentes adversos y transmitiendo las medidas de protección de la salud destinadas a evitar su repetición o a reducir sus consecuencias. Este real decreto establece las obligaciones de fabricantes, usuarios y otros responsables respecto a la comunicación de incidentes adversos a dicho sistema, así como el funcionamiento del mismo. A efectos de reforzar las garantías sanitarias, se establece la exigencia de tarjeta de implantación en determinados implantes para facilitar la adopción de medidas sobre los pacientes, en caso necesario.
Los productos a medida constituyen un grupo especial de productos, puesto que son destinados a ser utilizados por un paciente particular que presenta unas determinadas características. Por ello, este real decreto establece condiciones y procedimientos específicos que deben seguirse, incluyendo el establecimiento por el fabricante de un compromiso para la comunicación de incidentes adversos y para el seguimiento de los productos una vez comercializados.
De acuerdo con lo establecido en el artículo 100 de la Ley General de Sanidad, se someten a licencia previa de funcionamiento la fabricación, agrupación y esterilización de los productos, así como su importación, indicándose las condiciones que deben reunir las empresas que se dediquen a estas actividades, así como el procedimiento a seguir para el otorgamiento de dichas autorizaciones.
Teniendo en cuenta los principios del nuevo marco para la comercialización de los productos establecidos en la Decisión comunitaria n.º 768/2008, se introducen las obligaciones de los agentes económicos que intervienen en la cadena de comercialización de los productos: fabricantes, importadores y distribuidores, en relación con la conservación y mantenimiento de la documentación pertinente a disposición de las autoridades, la adopción de medidas correctoras ante cualquier sospecha o evidencia de riesgos para la salud o ante la falta de conformidad de los productos, la sujeción a las decisiones de las autoridades sanitarias y de colaboración y cooperación con las mismas, así como la trazabilidad destinada al seguimiento del producto en la cadena de comercialización. Asimismo se introduce la exigencia de designación de un representante autorizado establecido en la Unión Europea para los fabricantes no comunitarios.
Este real decreto establece las condiciones para el comercio exterior de los productos, especificando los requisitos a aplicar por la inspección sanitaria en su importación. A su vez, se determina la información a facilitar a las autoridades sanitarias sobre los productos en el momento de su puesta a disposición en territorio español, así como la relativa a las empresas españolas responsables de la puesta en el mercado.
Por otro lado, se regula la distribución y la venta, y en particular la venta de los productos que requieren una adaptación individualizada. Asimismo, se regula la publicidad y promoción de los productos, estableciéndose las condiciones en las que deben desarrollarse estas actividades, todo ello de acuerdo con las previsiones que establece en esta materia la Ley 29/2006, de 26 de julio, como salvaguarda del interés general de protección de la salud pública.
Por los mismos motivos, también se regulan la venta y la publicidad de los productos sanitarios para diagnóstico «in vitro», estableciéndose la exigencia de prescripción para la venta al público de determinados productos, cuyo ofrecimiento por medios telemáticos queda prohibido en aplicación de los principios establecidos en la Ley 29/2006, de 26 de julio, modificándose, en este sentido, el Real Decreto 1662/2000, de 29 de septiembre, sobre productos sanitarios para diagnóstico «in vitro».
Por último, se determinan las facultades de inspección y adopción de medidas de protección de la salud que corresponden a las autoridades sanitarias, así como el principio de cooperación administrativa en relación con otras autoridades nacionales y comunitarias.
Este real decreto no afecta a la aplicación del Real Decreto 1132/1990, de 14 de septiembre, por el que se establecen medidas fundamentales de protección radiológica de las personas sometidas a exámenes y tratamientos médicos; ni del Real Decreto 783/2001, de 6 de julio, por el que se aprueba el Reglamento de Protección Sanitaria contra Radiaciones Ionizantes; ni del Real Decreto 1836/1999, de 3 de diciembre, por el que se aprueba el Reglamento sobre instalaciones nucleares y radiactivas; así como tampoco a la del Real Decreto 1085/2009, de 3 de julio, por el que se aprueba el Reglamento sobre instalación y utilización de aparatos de rayos X con fines de diagnóstico médico.
Por otro lado, y en relación con aquellos productos que estén destinados por su fabricante a ser utilizados tanto de conformidad con las disposiciones sobre los equipos de protección individual del Real Decreto 1407/1992, de 20 de noviembre, por el que se regulan las condiciones para la comercialización y libre circulación intracomunitaria de los equipos de protección individual, como con las disposiciones de este real decreto, se cumplirán, asimismo, los requisitos esenciales de seguridad y de salud del Real Decreto 1407/1992, de 20 de noviembre.
Por medio de este real decreto se deroga el Real Decreto 414/1996, de 1 de marzo, por el que se regula los productos sanitarios, y sus sucesivas modificaciones.
Este real decreto se adopta en desarrollo de la Ley 14/1986, de 25 de abril, y de la Ley 29/2006, de 26 de julio, cuya disposición adicional tercera, apartado 1, faculta al Gobierno, para determinar reglamentariamente y de conformidad con lo dispuesto en esta Ley las condiciones y requisitos que cumplirán los productos sanitarios para su fabricación, importación, investigación clínica, distribución, comercialización, puesta en servicio, dispensación y utilización, así como los procedimientos administrativos respectivos, de acuerdo con lo establecido en la normativa de la Unión Europea.
De conformidad con lo dispuesto en el artículo 149.1.16.ª de la Constitución, este real decreto se dicta de acuerdo con la competencia que ostenta el Estado para regular la legislación de productos farmacéuticos, la sanidad exterior, y las bases y coordinación general de la sanidad, garantizando, en lo que concierne al tratamiento de los datos personales, el respeto a la Ley Orgánica 15/1999, de 13 de diciembre, de Protección de Datos de Carácter Personal, y su normativa de desarrollo.
En el proceso de elaboración de esta norma se ha consultado a las comunidades autónomas y se ha dado audiencia a los sectores afectados.
En su virtud, a propuesta de la Ministra de Sanidad y Política Social, con la aprobación previa de la Vicepresidenta Primera del Gobierno y Ministra de la Presidencia, de acuerdo con el Consejo de Estado, y previa deliberación del Consejo de Ministros, en su reunión del día 16 de octubre de 2009,
DISPONGO:
Este real decreto tiene por objeto regular los productos sanitarios y sus accesorios, y en particular:
a) Las garantías sanitarias de los productos y los requisitos esenciales que deben cumplir.
b) Los procedimientos para el otorgamiento de las licencias previas de funcionamiento de instalaciones.
c) Los requisitos para la evaluación de la conformidad de los productos sanitarios y para la colocación del marcado CE.
d) Los requisitos para la puesta en el mercado y en servicio de los productos sanitarios con una finalidad especial.
e) Los requisitos y las actuaciones de los organismos notificados.
f) La comercialización y puesta en servicio de los productos sanitarios.
g) El comercio intracomunitario y exterior de los productos sanitarios.
h) Las investigaciones clínicas con productos sanitarios.
i) El sistema de vigilancia de productos sanitarios.
j) La inspección y medidas de protección de la salud.
k) La publicidad y exhibiciones.
1. A los efectos de este real decreto, se entenderá por:
a) «Producto sanitario»: cualquier instrumento, dispositivo, equipo, programa informático, material u otro artículo, utilizado solo o en combinación, incluidos los programas informáticos destinados por su fabricante a finalidades específicas de diagnóstico y/o terapia y que intervengan en su buen funcionamiento, destinado por el fabricante a ser utilizado en seres humanos con fines de:
1.º Diagnóstico, prevención, control, tratamiento o alivio de una enfermedad,
2.º diagnóstico, control, tratamiento, alivio o compensación de una lesión o de una deficiencia,
3.º investigación, sustitución o modificación de la anatomía o de un proceso fisiológico,
4.º regulación de la concepción,
y que no ejerza la acción principal que se desee obtener en el interior o en la superficie del cuerpo humano por medios farmacológicos, inmunológicos ni metabólicos, pero a cuya función puedan contribuir tales medios.
b) «Accesorio»: un artículo que, sin ser un producto sanitario, es destinado específicamente por el fabricante a ser utilizado de forma conjunta con un producto para que este último pueda utilizarse de conformidad con la finalidad prevista para el producto por su fabricante.
c) «Producto sanitario para diagnóstico in vitro»: Cualquier producto sanitario que consista en un reactivo, producto reactivo, calibrador, material de control, estuche de instrumental y materiales, instrumento, aparato, equipo o sistema, utilizado solo o en asociación con otros, destinado por el fabricante a ser utilizado «in vitro» para el estudio de muestras procedentes del cuerpo humano, incluidas las donaciones de sangre y tejidos, sólo o principalmente con el fin de proporcionar información relativa a un estado fisiológico o patológico, o relativa a una anomalía congénita, o para determinar la seguridad y compatibilidad con receptores potenciales, o para supervisar medidas terapéuticas.
Los recipientes para muestras se considerarán productos sanitarios para diagnóstico «in vitro». Por «recipientes para muestras» se entienden los productos, tanto si en ellos se ha hecho el vacío como si no, destinados específicamente por el fabricante a la contención directa y a la conservación de muestras procedentes del cuerpo humano para un examen diagnóstico «in vitro».
No se considerarán productos sanitarios para diagnóstico «in vitro» los artículos de uso general en laboratorio, salvo cuando, por sus características, estén destinados específicamente por el fabricante a usarse en exámenes diagnósticos «in vitro».
d) «Producto a medida»: un producto sanitario fabricado específicamente según la prescripción escrita de un facultativo especialista, en la que éste haga constar bajo su responsabilidad las características específicas de diseño, y que se destine únicamente a un paciente determinado.
Los productos fabricados según métodos de fabricación continua o en serie que necesiten una adaptación para satisfacer necesidades específicas del médico o de otro usuario profesional no se considerarán productos a medida.
e) «Producto destinado a investigaciones clínicas»: cualquier producto destinado a ser puesto a disposición de un facultativo especialista para llevar a cabo las investigaciones contempladas en el apartado 2.1 del anexo X, efectuadas en un entorno clínico humano adecuado.
f) «Fabricante»: la persona física o jurídica responsable del diseño, fabricación, acondicionamiento y etiquetado de un producto sanitario con vistas a la puesta en el mercado de éste en su propio nombre, independientemente de que estas operaciones sean efectuadas por esta misma persona o por un tercero por cuenta de aquélla.
Las obligaciones a que están sujetos los fabricantes en virtud de este real decreto, se aplicarán asimismo a la persona física o jurídica que monte, acondicione, trate, renueve totalmente y/o etiquete uno o varios productos prefabricados y/o les asigne una finalidad como producto con vistas a la puesta en el mercado de los mismos en su propio nombre. El presente párrafo no se aplicará a la persona que, sin ser fabricante con arreglo al párrafo primero, monte o adapte con arreglo a su finalidad prevista productos ya comercializados, para un paciente determinado.
g) «Finalidad prevista»: la utilización a la que se destina el producto sanitario según las indicaciones proporcionadas por el fabricante en el etiquetado, las instrucciones de utilización y/o el material publicitario.
h) «Puesta en el mercado»: la primera puesta a disposición, a título oneroso o gratuito, de un producto sanitario, no destinado a investigaciones clínicas, con vistas a su distribución y/o utilización en el mercado comunitario, independientemente de que se trate de un producto nuevo o totalmente renovado.
i) «Puesta en servicio»: la fase en la que un producto, que está listo para ser utilizado en el mercado comunitario por primera vez con arreglo a su finalidad prevista, es puesto a disposición del usuario final.
j) «Representante autorizado»: cualquier persona física o jurídica establecida en la Unión Europea, designada expresamente por el fabricante, que actúe en su lugar y a la que puedan dirigirse las autoridades y organismos en la Unión Europea en lugar de al fabricante por lo que respecta a las obligaciones de éste con arreglo a este real decreto.
k) «Datos clínicos»: la información en materia de seguridad y/o prestaciones derivadas del uso de un producto; los datos clínicos se obtienen de:
1.º la investigación clínica del producto en cuestión, o
2.º la investigación clínica u otros estudios mencionados en publicaciones científicas, de un producto similar cuya equivalencia con el producto en cuestión pueda demostrarse, o
3.º informes publicados o no sobre otras experiencias clínicas con el producto en cuestión, o con un producto similar cuya equivalencia con aquel pueda demostrarse.
l) «Subcategoría de productos»: conjunto de productos con áreas comunes de finalidades previstas o tecnología común.
m) «Grupo de productos genéricos»: conjunto de productos con idénticas o similares finalidades previstas o tecnología común, lo que permite clasificarlos de forma genérica sin mencionar sus características específicas.
n) «Producto de un solo uso»: producto destinado a ser utilizado una sola vez en un único paciente.
ñ) «Facultativo especialista»: médico o cualquier otra persona que, en virtud de sus cualificaciones profesionales, se encuentra legalmente autorizado para extender la prescripción o realizar la investigación de que se trate.
o) «Importador»: toda persona física o jurídica establecida en la Unión Europea que introduce un producto de un tercer país en territorio comunitario.
p) «Distribuidor»: toda persona física o jurídica de la cadena de suministro distinta del fabricante o del importador que comercializa un producto.
q) «Célula»: la unidad organizada más pequeña de cualquier forma de vida, capaz de tener una existencia independiente y de reproducirse en un entorno idóneo.
r) «Tejido»: una organización de células, de componentes extracelulares o de ambos.
s) «Derivado»: un material obtenido a partir de un tejido de origen animal mediante un proceso de fabricación, como el colágeno, la gelatina o los anticuerpos monoclonales.
t) «Inviable»: todo lo que no tenga capacidad de metabolismo o multiplicación.
u) «Agentes transmisibles»: las entidades patógenas no clasificadas, los priones y otras entidades como los agentes de la encefalopatía espongiforme bovina y de la tembladera.
v) «Reducción, eliminación o retirada»: un proceso mediante el cual se reduce, elimina o retira el número de agentes transmisibles, con objeto de evitar una infección o una reacción patógena.
w) «Inactivación»: un proceso mediante el cual se reduce la capacidad de los agentes transmisibles de causar una infección o una reacción patógena.
x) «País de origen»: el país en el que el animal haya nacido, se haya criado y/o haya sido sacrificado.
y) «Materiales de partida»: las materias primas o cualquier otro producto de origen animal a partir del cual, o con ayuda del cual, se elaboren los productos a los que hace referencia el artículo 5, apartado 3.
z) «Comercialización»: todo suministro, remunerado o gratuito, para su distribución o utilización en el mercado comunitario en el transcurso de una actividad comercial.
a´) «Promotor»: fabricante, representante autorizado u otro individuo u organización que asume la responsabilidad de la iniciación y/o puesta en práctica de una investigación clínica.
2. Las definiciones contempladas en el apartado 1, desde la letra q) a la y), se aplicarán en el ámbito de los productos que incorporen derivados de origen animal.
1. Este real decreto se aplicará a:
a) Los productos sanitarios y sus accesorios. Los accesorios recibirán un tratamiento idéntico al de los productos sanitarios. En lo sucesivo ambos se denominarán «productos».
b) Las condiciones para la utilización de los productos en investigaciones clínicas.
c) Las lentes de contacto sin finalidad correctiva; los aparatos e instrumental utilizados en el maquillaje permanente, semipermanente o en el tatuaje de la piel mediante técnicas invasivas.
Estos productos no podrán ostentar el marcado CE y deberán cumplir los requisitos esenciales que les sean de aplicación. Su fabricación, importación, distribución y venta quedarán sometidas a vigilancia por las autoridades sanitarias competentes, debiendo satisfacer los procedimientos señalados en los artículos 9 y 27.
2. La Agencia Española de Medicamentos y Productos Sanitarios decidirá sobre la aplicación a un producto de las definiciones contempladas en el artículo 2, apartado 1, letras de la a) a la e) de este real decreto.
Cuando la Agencia Española de Medicamentos y Productos Sanitarios considere que se requiere una decisión sobre si a un producto o grupo de productos se le aplica alguna de las definiciones del artículo 2, apartado 1 letras de la a) a la e), presentará a la Comisión Europea una solicitud debidamente justificada para que adopte las medidas necesarias.
3. Cuando un producto sanitario esté destinado a la administración de un medicamento, dicho producto estará regulado por este real decreto y el medicamento deberá ajustarse a lo establecido en la Ley 29/2006, de 26 de julio, de garantías y uso racional de los medicamentos y productos sanitarios, y disposiciones que la desarrollan.
No obstante, en caso de que un producto de esta índole se ponga en el mercado de tal modo que el producto y el medicamento constituyan un solo producto integrado destinado a ser utilizado exclusivamente en tal asociación y que no sea reutilizable, dicho producto se regirá por lo dispuesto en el Real Decreto 1345/2007, de 11 de octubre, por el que se regula el procedimiento de autorización, registro y condiciones de dispensación de los medicamentos de uso humano fabricados industrialmente. En lo que se refiere a las características del producto relacionadas con su seguridad y sus prestaciones serán aplicables los correspondientes requisitos recogidos en el artículo 5 y en el anexo I de este real decreto.
4. Cuando un producto incorpore, como parte integrante, una sustancia que, de utilizarse por separado, pueda ser considerada un medicamento, con arreglo a la definición del artículo 2.1 del Real Decreto 1345/2007, de 11 de octubre, y que pueda ejercer en el cuerpo humano una acción accesoria a la del producto, dicho producto se evaluará y autorizará de conformidad con las disposiciones de este real decreto.
5. Cuando un producto incorpore, como parte integrante, una sustancia que, de utilizarse por separado, pueda considerarse un componente de un medicamento o un medicamento derivado de la sangre o plasma humanos, con arreglo a la definición del artículo 2.18 del Real Decreto 1345/2007, de 11 de octubre, y que pueda ejercer en el cuerpo humano una acción accesoria a la del producto, denominado en lo sucesivo «sustancias derivadas de la sangre humana», dicho producto se evaluará y autorizará de conformidad con las disposiciones de este real decreto.
6. Cuando un producto esté destinado por su fabricante a ser utilizado tanto de conformidad con las disposiciones sobre los equipos de protección individual del Real Decreto 1407/1992, de 20 de noviembre, por el que se regulan las condiciones para la comercialización y libre circulación intracomunitaria de los equipos de protección individual, como con las disposiciones de este real decreto, se cumplirán, asimismo, los requisitos esenciales de seguridad y de salud del Real Decreto 1407/1992, de 20 de noviembre.
7. A los productos sanitarios cuya conformidad haya sido determinada de acuerdo con este real decreto no les resulta de aplicación el Real Decreto 1580/2006, de 22 de diciembre, por el que se regula la compatibilidad electromagnética de los equipos eléctricos y electrónicos.
8. La presente disposición no afectará a la aplicación del Real Decreto 1132/1990, de 14 de septiembre, por el que se establecen medidas fundamentales de protección radiológica de las personas sometidas a exámenes y tratamientos médicos; ni del Real Decreto 783/2001, de 6 de julio, por el que se aprueba el Reglamento de Protección Sanitaria contra Radiaciones Ionizantes; ni del Real Decreto 1836/1999, de 3 de diciembre, por el que se aprueba el Reglamento sobre instalaciones nucleares y radiactivas; así como tampoco a la del Real Decreto 1085/2009, de 3 de julio, por el que se aprueba el Reglamento sobre instalación y utilización de aparatos de rayos X con fines de diagnóstico médico.
9. Este real decreto no se aplicará a:
a) Los productos sanitarios para diagnóstico «in vitro».
b) Los productos sanitarios implantables activos.
c) Los medicamentos. La decisión sobre si un determinado producto está regulado por el Real Decreto 1345/2007, de 11 de octubre, o por la presente disposición se tomará teniendo en cuenta, fundamentalmente, el modo de acción principal del producto.
d) Los productos cosméticos.
e) La sangre humana, los productos derivados de la sangre humana, el plasma o las células sanguíneas de origen humano y los productos que en el momento de su puesta en el mercado contengan dichos productos derivados de la sangre humana, plasma o células sanguíneas, con excepción de los productos referidos en el apartado 5.
f) Los órganos, los tejidos o las células de origen humano y los productos que incorporen tejidos o células de origen humano o deriven de ellos, con excepción de los productos referidos en el apartado 5.
g) Los órganos, los tejidos o las células de origen animal, excepto en los casos en que un producto haya sido elaborado con tejidos animales que hayan sido transformados en inviables o con productos inviables derivados de tejidos animales.
1. Los productos sólo pueden ponerse en el mercado y/o ponerse en servicio si cumplen los requisitos establecidos en este real decreto cuando hayan sido debidamente suministrados, estén correctamente instalados y mantenidos y se utilicen conforme a su finalidad prevista, no comprometiendo la seguridad ni la salud de los pacientes, de los usuarios ni, en su caso, de terceros.
2. En el momento de su puesta en servicio en España los productos deben incluir los datos e informaciones contenidos en el apartado 13 del anexo I, al menos, en español, de modo que permitan disponer de forma cierta y objetiva de una información eficaz, veraz y suficiente sobre sus características esenciales.
3. No podrán comercializarse productos cuyo etiquetado o material promocional contenga menciones o distintivos que induzcan a error, atribuya funciones que no posean o proporcione expectativas de éxito asegurado o de que tras su uso indicado o prolongado no aparecerá ningún efecto nocivo. Tampoco podrá atribuir carácter superfluo a la intervención médica o quirúrgica.
4. Sólo podrán utilizarse en España productos que cumplan las disposiciones de este real decreto y por profesionales cualificados y debidamente adiestrados, dependiendo del producto de que se trate. Los productos deberán utilizarse en las condiciones y según las finalidades previstas por el fabricante de los mismos.
Los productos deberán ser mantenidos adecuadamente de forma que se garantice que, durante su período de utilización, conservan la seguridad y prestaciones previstas por su fabricante.
5. De acuerdo con lo establecido en la Ley 41/2002, de 14 de noviembre, básica reguladora de la autonomía del paciente y de derechos y obligaciones en materia de información y documentación clínica, se facilitará al paciente y se incluirá en su historia clínica la información sobre cualquier producto sanitario implantable que reciba en el curso de su tratamiento. Lo expresado será sin perjuicio de lo indicado en el artículo 33 sobre la exigencia de tarjetas de implantación en determinados tipos de implantes.
1. Los productos deberán cumplir los requisitos esenciales establecidos en el anexo I que les sean aplicables teniendo en cuenta su finalidad prevista.
2. Cuando exista el correspondiente riesgo, los productos que sean máquinas de acuerdo con lo previsto en el Real Decreto 1644/2008, de 10 de octubre, por el que se establecen las normas para la comercialización y puesta en servicio de las máquinas, deberán cumplir asimismo los requisitos esenciales de seguridad y de salud previstos en el mismo, siempre que tales requisitos esenciales de seguridad y de salud sean más específicos que los requisitos esenciales previstos en el anexo I de este real decreto.
3. Los productos en cuya elaboración se utilicen tejidos de origen animal transformados en inviables o productos inviables derivados de tejidos de origen animal procedentes de las especies bovina, ovina y caprina, así como los procedentes de ciervos, alces, visones y gatos, deberán cumplir las especificaciones detalladas relativas a los riesgos de transmisión de encefalopatías espongiformes transmisibles (EET) en condiciones normales de utilización a pacientes u otras personas, recogidas en el anexo XIII de este real decreto. Esto no resultará de aplicación cuando los productos no estén destinados a entrar en contacto con el cuerpo humano o estén destinados a entrar en contacto únicamente con piel intacta.
El colágeno, la gelatina y el sebo de las especies citadas en el párrafo anterior, utilizados en la elaboración de los productos, deberán cumplir, como mínimo, los requisitos necesarios para el consumo humano.
1. Cuando los productos sanitarios se ajusten a las normas nacionales correspondientes, adoptadas en aplicación de normas armonizadas que satisfagan determinados requisitos esenciales, se presumirán conformes a los requisitos esenciales de que se trate.
2. A los efectos del apartado anterior, las normas nacionales y las normas armonizadas son aquellas cuyos números de referencia se hayan publicado en el «Boletín Oficial del Estado» y en el «Diario Oficial de la Unión Europea», respectivamente.
3. Asimismo, se considerarán, a los efectos del apartado segundo, las monografías de la Farmacopea Europea relativas, en particular, a las suturas quirúrgicas y a la interacción entre medicamentos y materiales utilizados como recipientes de los medicamentos, cuyas referencias se hayan publicado en el «Diario Oficial de la Unión Europea».
1. Sin perjuicio de las disposiciones existentes en materia de secreto profesional, las autoridades sanitarias velarán porque todas las partes a las que concierne la aplicación de este real decreto mantengan la confidencialidad de cualquier información obtenida en el ejercicio de su función. Ello no afectará a las obligaciones de las autoridades competentes ni de los organismos notificados con respecto a la información recíproca y a la difusión de advertencias, ni a las obligaciones de información que incumban a las personas interesadas, tanto ante las autoridades sanitarias como ante los órganos jurisdiccionales.
2. No se considerará confidencial la siguiente información:
a) La información sobre el registro de personas responsables de la puesta en el mercado de los productos con arreglo al artículo 24;
b) la información destinada a los usuarios remitida por el fabricante, el representante autorizado, el importador o el distribuidor en relación con una medida con arreglo al artículo 32; ni
c) la información recogida en los certificados expedidos, modificados, completados, suspendidos o retirados.
1. La Agencia Española de Medicamentos y Productos Sanitarios cooperará con las autoridades competentes del resto de Estados miembros y con la Comisión Europea, transmitiéndose entre sí la información necesaria para aplicar con uniformidad las disposiciones aplicables a los productos sanitarios.
2. La cooperación establecida en el apartado anterior, podrá formar parte de iniciativas desarrolladas a nivel internacional.
3. Igualmente, la Agencia Española de Medicamentos y Productos Sanitarios y las comunidades autónomas cooperarán en el ámbito de sus competencias.
1. De acuerdo con el artículo 100 de la Ley 14/1986, de 25 de abril, General de Sanidad, las personas físicas o jurídicas que se dediquen a la fabricación, importación, agrupación o esterilización de productos sanitarios y las instalaciones en que se lleven a cabo dichas actividades requerirán licencia previa de funcionamiento, otorgada por la Agencia Española de Medicamentos y Productos Sanitarios.
No obstante lo indicado en el párrafo anterior, los establecimientos y las actividades de las personas físicas o jurídicas que se dediquen a la fabricación de productos a medida requerirán licencia previa de funcionamiento otorgada por las autoridades sanitarias de la comunidad autónoma correspondiente.
2. Se otorgará una única licencia previa de funcionamiento que amparará las instalaciones y las actividades que se desarrollarán en las mismas, tanto propias como concertadas.
3. Para la obtención de las autorizaciones contempladas en el párrafo primero del apartado 1, éstas se solicitarán a la Agencia Española de Medicamentos y Productos Sanitarios, la cual estudiará la documentación presentada y notificará la resolución en el plazo de tres meses a contar desde la fecha en que la solicitud y la documentación que la acompaña hayan tenido entrada en su registro.
4. La Agencia Española de Medicamentos y Productos Sanitarios solicitará a las áreas funcionales de sanidad de las Delegaciones del Gobierno informe sobre las condiciones en que las empresas vayan a desarrollar las actividades relacionadas en el párrafo primero del apartado 1, ordenando a estos efectos las inspecciones de las instalaciones que resulten necesarias. La solicitud de dicho informe suspenderá, por un plazo máximo de tres meses, la tramitación del procedimiento según lo previsto en el artículo 42.5.c) de la Ley 30/1992, de 26 de noviembre, de Régimen Jurídico de las Administraciones Públicas y del Procedimiento Administrativo Común. La petición de dicho informe y su recepción le será comunicada a la empresa interesada.
No obstante lo dispuesto en el párrafo anterior, de forma excepcional, por razones de urgencia o cuando la naturaleza de las actividades lo aconseje, el citado informe y la correspondiente inspección podrán ser realizados por la propia Agencia Española de Medicamentos y Productos Sanitarios.
5. Cuando las empresas desarrollen las actividades de fabricación, agrupación, esterilización o almacenamiento en instalaciones establecidas fuera del territorio español, los informes e inspecciones citados en los párrafos anteriores podrán ser sustituidos por documentación que avale convenientemente las actividades desarrolladas.
6. La Agencia Española de Medicamentos y Productos Sanitarios procederá a la denegación, suspensión o revocación de las licencias de funcionamiento cuando de la documentación aportada o de los informes de inspección correspondientes no quede garantizado que la empresa dispone de las instalaciones, medios, procedimientos y personal adecuados para desarrollar las respectivas actividades o cuando no se mantengan las condiciones en las que se otorgó la licencia.
7. La Agencia Española de Medicamentos y Productos Sanitarios y las autoridades sanitarias de las comunidades autónomas se mantendrán informadas mutuamente de las licencias de funcionamiento otorgadas de acuerdo con lo expresado en este artículo, así como de sus modificaciones, suspensiones o revocaciones.
8. Las licencias de funcionamiento tendrán un periodo de validez que se especificará en el documento de autorización y podrán revalidarse a petición del interesado, una vez verificado el cumplimiento de requisitos.
Cualquier modificación de las condiciones en que se otorgó la licencia de funcionamiento debe autorizarse previamente por el mismo órgano que la otorgó.
9. La concertación de actividades por parte de los fabricantes no exime a éstos de la responsabilidad última de los eventuales incumplimientos de los subcontratistas.
1. A la solicitud de licencia previa de funcionamiento deberá acompañarse la documentación acreditativa de los siguientes requisitos:
a) Disponibilidad de una estructura organizativa capaz de garantizar la calidad de los productos y la ejecución de los procedimientos y controles procedentes.
b) Disponibilidad de instalaciones, procedimientos, equipamiento y personal adecuados según las actividades y productos de que se trate. En caso de actividades concertadas las empresas deberán declarar el nombre y dirección de los subcontratados, describir las actividades y medios disponibles para realizarlas, aportar los contratos correspondientes y los procedimientos de fabricación y control utilizados. Tales actividades concertadas solo podrán ser realizadas por entidades que reúnan los requisitos establecidos para los fabricantes, con excepción de la licencia previa de funcionamiento en el caso de las entidades que no respondan a la definición de fabricante.
c) Disponibilidad de un responsable técnico, titulado universitario, cuya titulación acredite una cualificación adecuada en función de los productos que tenga a su cargo, quien ejercerá la supervisión directa de tales actividades.
No obstante lo dispuesto en el párrafo anterior, el desempeño de las funciones de técnico responsable de la supervisión de las actividades de fabricación de productos a medida, en los sectores de la ortopedia y la prótesis dental, se ajustará a lo establecido en la disposición final primera.
La disponibilidad se acreditará mediante contrato en el que se especificará la dedicación horaria del técnico responsable, la cual deberá ser suficiente en función del tipo y volumen de la actividad de la empresa.
d) Disponibilidad de un sistema de archivo documental para almacenar la documentación generada con cada producto fabricado o importado y mantenimiento de un registro de todos los productos. El archivo documental se mantendrá a disposición de las autoridades competentes.
El archivo de fabricantes contendrá:
1.º La documentación relativa al sistema de calidad y a las especificaciones de cada producto fabricado, incluidos etiquetado e instrucciones de uso.
2.º La documentación que permita el seguimiento de los productos dentro de la cadena de producción y control, así como su identificación inequívoca.
3.º La documentación relativa a la experiencia adquirida con la utilización de los productos, incluida la derivada del sistema de vigilancia, así como las reclamaciones y devoluciones.
4.º La documentación que permita comprender el diseño, la fabricación y las prestaciones del producto, de manera que pueda evaluarse su conformidad con los requisitos esenciales.
5.º La documentación relativa a la comercialización, que contendrá los datos identificativos del producto (nombre comercial, modelo, número de lote/ serie), la fecha de fabricación, y la fecha de envío, suministro o entrega.
6.º La documentación señalada en los anexos correspondientes al procedimiento de evaluación de la conformidad aplicado por el fabricante.
La documentación señalada en los puntos 2.º y 4.º podrá figurar en las empresas subcontratadas siempre que quede garantizado su acceso a las autoridades sanitarias.
En el caso de importadores, el contenido del archivo documental se referirá a las actividades de importación y control desempeñadas y su alcance permitirá el cumplimiento de las obligaciones señaladas en el artículo 26.
e) Disponibilidad de una persona de contacto para las actuaciones relacionadas con el Sistema de vigilancia. Esta designación puede recaer en el responsable técnico de la empresa.
f) Disponibilidad de un procedimiento para aplicar las medidas de restricción o seguimiento de la utilización de los productos que resulten adecuadas, así como aquellas que, en su caso, determinen las autoridades competentes.
1. Los productos se clasifican en clase I, IIa, IIb y III. La adscripción de cada producto a una clase determinada se llevará a cabo de acuerdo con los criterios establecidos en el anexo IX de este real decreto.
2. En caso de controversia entre el fabricante y el organismo notificado por razón de la aplicación de los criterios de clasificación, el caso se remitirá para decisión a las autoridades competentes de las que dependa dicho organismo. En caso de tratarse de un organismo notificado español, se acudirá a la Agencia Española de Medicamentos y Productos Sanitarios.
3. La Agencia Española de Medicamentos y Productos Sanitarios decidirá sobre la clasificación que corresponde a los productos aplicando los criterios establecidos en el anexo IX.
4. Cuando la Agencia Española de Medicamentos y Productos Sanitarios considere que las reglas de clasificación establecidas en el anexo IX deben ser adaptadas, habida cuenta del progreso técnico y de cualquier otra información de la que se disponga en virtud del Sistema de vigilancia previsto en el artículo 32, podrá presentar a la Comisión Europea una solicitud debidamente justificada para que adopte las medidas necesarias en orden a la adaptación de las reglas de clasificación.
5. La Agencia Española de Medicamentos y Productos Sanitarios presentará a la Comisión Europea una solicitud debidamente justificada para que adopte las medidas necesarias cuando considere que:
a) la aplicación de las reglas de clasificación establecidas en el anexo IX requieren una decisión en relación con la clasificación de un determinado producto o categoría de productos;
b) un determinado producto o familia de productos deben ser clasificados, por excepción a lo dispuesto en el anexo IX, en otra clase.
6. No obstante las reglas establecidas en el anexo IX de este real decreto, los implantes mamarios se clasifican como productos sanitarios incluidos en la clase III.
7. No obstante las reglas establecidas en el anexo IX de este real decreto, las prótesis articulares de cadera, rodilla y hombro, se clasifican como productos sanitarios incluidos en la clase III.
A estos efectos se entenderá por prótesis articulares de cadera, rodilla y hombro el conjunto de componentes implantables de un sistema de prótesis articular total destinado a desempeñar una función similar a las articulaciones naturales, respectivamente, de la cadera, la rodilla o el hombro. Quedan excluidos de la presente definición los dispositivos accesorios (tornillos, cuñas, placas o instrumental).
1. Sólo podrán ponerse en el mercado y ponerse en servicio productos que ostenten el marcado CE. Como excepción, los productos a medida y los destinados a investigaciones clínicas no llevarán marcado CE.
El marcado CE será colocado únicamente por el fabricante o su representante autorizado y sólo podrá colocarse en productos que hayan demostrado su conformidad con los requisitos esenciales señalados en el artículo 5 y que hayan seguido los procedimientos de evaluación de la conformidad señalados en el artículo 13.
2. El marcado CE de conformidad, que se reproduce en el anexo XII, deberá colocarse de manera visible, legible e indeleble en el producto o en el envase del producto que garantice la esterilidad, siempre que ello resulte posible y adecuado, y en las instrucciones de utilización; igualmente se colocará en el envase exterior, si lo hubiere.
3. El marcado CE irá seguido del número de identificación del organismo notificado responsable de la ejecución de los procedimientos de evaluación recogidos en los anexos II, IV, V o VI, según proceda.
En el caso de productos para los que el procedimiento de evaluación de la conformidad no requiere la intervención de un organismo notificado, el marcado CE no podrá ir acompañado de ningún número de identificación de un organismo notificado.
4. Queda prohibido colocar marcas o inscripciones que puedan inducir a error a terceros en relación con el significado o el logotipo del marcado CE. Podrá colocarse cualquier otro marcado en el producto, en el envase o en las instrucciones de utilización que acompañan al producto, a condición de que no se reduzca la visibilidad y legibilidad del marcado CE.
Tampoco podrá colocarse el marcado de conformidad CE amparándose en lo previsto en este real decreto en productos que no se ajusten a las definiciones recogidas en el artículo 2, apartado 1, letras a) y b).
5. En el caso de productos a los que sean de aplicación otras regulaciones, referentes a otros aspectos en los cuales se prevea la colocación del marcado CE, sólo podrá colocarse este marcado si los productos cumplen también las disposiciones pertinentes de las mismas.
No obstante, si una o varias disposiciones permitieran que el fabricante, durante un período transitorio, elija qué medidas aplicar, el marcado CE indicará que los productos sólo cumplen lo dispuesto en las regulaciones aplicadas por el fabricante.
En tal caso, las referencias de dichas regulaciones, tal y como se hayan publicado en el «Diario Oficial de la Unión Europea», deberán figurar en la documentación, los prospectos, o las instrucciones que, estipulados por las mismas, acompañen a dichos productos. Dichos documentos deberán ser accesibles sin que tenga que destruirse el embalaje que garantiza la esterilidad del producto.
6. Cuando un producto ostente el marcado CE incumpliendo lo establecido en el presente artículo, se considerará que ha sido objeto de un marcado CE indebido y se tratará, a todos los efectos, como producto no conforme. Este mismo tratamiento se dará a los productos en los que el marcado CE no figure debiendo figurar.
1. El fabricante, a efectos de la colocación del marcado CE, deberá optar, de acuerdo con la clase de producto de que se trate, por cualquiera de los procedimientos de evaluación de la conformidad siguientes:
a) Productos de la clase III:
1.º Declaración CE de conformidad (sistema completo de garantía de calidad) a que se refiere el anexo II; o
2.º Examen CE de tipo a que se refiere el anexo III, en combinación:
1.ª Con la verificación CE a que se refiere el anexo IV, o bien
2.ª Con la declaración CE de conformidad (garantía de calidad de la producción) a que se refiere el anexo V.
b) Productos de la clase IIb:
1.º Declaración CE de conformidad (sistema completo de garantía de calidad) a que se refiere el anexo II; en este caso no se aplicará el apartado 4 del anexo II; o
2.º Examen CE de tipo a que se refiere el anexo III, en combinación:
1.ª Con la verificación CE a que se refiere el anexo IV, o bien
2.ª Con la declaración CE de conformidad (garantía de calidad de la producción) a que se refiere el anexo V, o bien
3.ª Con la declaración CE de conformidad (garantía de calidad del producto) a que se refiere el anexo VI.
c) Productos de la clase IIa:
Declaración CE de conformidad a que se refiere en el anexo VII en combinación:
1.º Con la verificación CE a que se refiere el anexo IV, o bien,
2.º Con la declaración CE de conformidad (garantía de calidad de la producción) a que se refiere el anexo V, o bien
3.º Con la declaración CE de conformidad (garantía de calidad del producto) a que se refiere el anexo VI.
En lugar de aplicar dichos procedimientos, el fabricante podrá seguir igualmente el procedimiento contemplado en el párrafo 1.º del apartado 1.b)
d) Productos de la clase I: el fabricante deberá seguir el procedimiento a que se refiere el anexo VII y efectuar, antes de la puesta en el mercado, la declaración CE de conformidad necesaria.
Cuando el fabricante o el representante autorizado esté establecido en España, la Agencia Española de Medicamentos y Productos Sanitarios evaluará, en su caso, la documentación señalada en el anexo VII, a efectos de establecer la conformidad de los productos después de que éstos hayan sido puestos en el mercado y/o puestos en servicio.
2. El fabricante de los productos señalados en el apartado 3 del artículo 5 deberá llevar a cabo el análisis del riesgo y la estrategia de gestión del riesgo previsto en el anexo XIII, antes de presentar la solicitud de evaluación de la conformidad.
3. El fabricante podrá encargar a su representante autorizado, que inicie los procedimientos a que se refieren los anexos III, IV, VII y VIII. Tanto el fabricante como su representante autorizado, en el curso de tales procedimientos, quedan sometidos a las obligaciones que se establecen en los correspondientes anexos.
4. Cuando la Agencia Española de Medicamentos y Productos Sanitarios considere que la conformidad de un producto o de una familia de productos deba establecerse, no obstante lo dispuesto en el apartado 1, aplicando exclusivamente uno de los procedimientos determinados, elegido entre los que contempla este artículo, presentará una solicitud debidamente justificada a la Comisión Europea para que ésta adopte las medidas necesarias.
1. Toda persona física o jurídica que agrupe productos que lleven el marcado CE, conforme a su finalidad y dentro de los límites de utilización previstos por sus fabricantes con el fin de ponerlos en el mercado como sistemas, conjuntos o equipos para procedimientos médicos o quirúrgicos, deberá efectuar una declaración en la que certifique que:
a) Ha verificado la compatibilidad recíproca de los productos con arreglo a las instrucciones de los fabricantes y ha realizado el agrupamiento siguiendo dichas instrucciones,
b) Ha embalado el sistema, conjunto o equipo para procedimientos médicos o quirúrgicos y facilitado la correspondiente información a los usuarios, incorporando las correspondientes instrucciones de los fabricantes, y que
c) Todas estas actividades se someten a métodos adecuados de control e inspección internos.
2. Cuando no se observen las citadas condiciones, el sistema, conjunto o equipo para procedimientos médicos o quirúrgicos se tratará como producto por derecho propio y se someterá al procedimiento correspondiente establecido en el artículo 13 de este real decreto. En particular, esta opción se aplicará a los casos en que el sistema, conjunto o equipo para procedimientos médicos o quirúrgicos incluya productos que no lleven el marcado CE o cuando la combinación de productos elegida no sea compatible a la vista de la utilización original prevista.
3. Toda persona física o jurídica que esterilice para su puesta en el mercado sistemas, conjuntos o equipos para procedimientos médicos o quirúrgicos contemplados en los apartados anteriores, así como otros productos que ostenten el marcado CE y que hayan sido destinados por sus fabricantes a ser esterilizados antes de su uso, deberá optar por uno de los procedimientos establecidos en los anexos II y V. La aplicación de los citados anexos y la intervención del organismo notificado se limitarán a los aspectos del procedimiento relativos a la obtención de la esterilidad hasta la apertura o el deterioro del envase protector de la misma. La persona efectuará una declaración haciendo constar que la esterilización se ha efectuado con arreglo a las instrucciones del fabricante.
4. Los productos a que se refieren los apartados 1 y 3 irán acompañados de la información recogida en el apartado 13 del anexo I de este real decreto, incluyendo, cuando proceda, la información suministrada por los fabricantes de los productos que han sido agrupados. En todo caso estos productos no precisarán de un nuevo marcado CE.
La declaración que se establece en los apartados 1 y 3 se deberá tener a disposición de las autoridades competentes por un periodo de cinco años, desde el agrupamiento o la esterilización de los productos.
La Agencia Española de Medicamentos y Productos Sanitarios podrá autorizar de forma expresa e individualizada en interés de la protección de la salud, la puesta en el mercado y la puesta en servicio de productos para los cuales no se hayan satisfecho los procedimientos de evaluación de la conformidad indicados en el artículo 13.
1. Los productos a medida no irán provistos del marcado CE ni les será de aplicación la comunicación prevista en el artículo 22.
2. Sólo podrán ponerse en el mercado y ponerse en servicio productos a medida cuando:
a) Su fabricante o representante autorizado haya seguido el procedimiento a que se refiere el anexo VIII y haya efectuado antes de la puesta en el mercado la declaración de conformidad necesaria, y
b) en el caso de que se trate de un producto de las clases IIa, IIb o III, éste vaya acompañado de la declaración prevista en el anexo VIII, la cual estará a disposición del paciente, que se identificará por su nombre, un acrónimo o un código numérico.
El paciente será informado de que tiene a su disposición esta declaración, la cual le será entregada a su requerimiento.
3. El fabricante o cualquier persona que ponga en servicio en España productos a medida deberá tener a disposición de las autoridades competentes, durante un período de al menos 5 años, la relación de los productos que haya puesto en servicio en España, junto con copia de la declaración que figura en el apartado 2.1 del anexo VIII y de la documentación del apartado 3.1 de dicho anexo. En el caso de productos implantables, el periodo será de, al menos, 15 años.
4. Los fabricantes establecidos en España que pongan en el mercado productos a medida deberán inscribirse en el Registro de Responsables de la puesta en el mercado regulado en el artículo 24. Esta obligación se hará extensiva al representante autorizado cuando se encuentre establecido en España.
1. Los productos destinados a investigaciones clínicas no irán provistos del marcado CE ni les será de aplicación la comunicación prevista en el artículo 22.
2. Sólo podrán ser puestos a disposición de un facultativo especialista para su utilización en investigaciones clínicas aquellos productos en los que:
a) Su fabricante o representante autorizado haya seguido el procedimiento a que se refiere el anexo VIII y haya establecido la declaración de conformidad necesaria, y
b) la investigación se atenga a lo dispuesto en los artículos 30 y 31.
3. El fabricante de un producto destinado a investigaciones clínicas o su representante autorizado deberá tener a disposición de las autoridades competentes, durante un período de 5 años, la declaración que figura en el apartado 2.2 del anexo VIII y la documentación del apartado 3.2 de dicho anexo, así como el informe contemplado en el apartado 2.3.7 del anexo X. En el caso de productos implantables, el periodo será de, al menos, 15 años.
1. El Ministerio de Sanidad y Política Social designará los organismos que efectuarán los procedimientos recogidos en los artículos 13 y 14, así como las tareas específicas asignadas a cada organismo, y lo notificará a la Comisión Europea y a los demás Estados miembros. Tal designación será publicada en el «Boletín Oficial del Estado» junto con el número de identificación asignado por la Comisión Europea y las tareas específicas.
El Ministerio de Sanidad y Política Social realizará las actuaciones necesarias para comprobar la aptitud de los organismos en orden a su designación y para verificar el mantenimiento de estas aptitudes en los organismos designados.
2. Los organismos notificados deberán cumplir los requisitos contemplados en el anexo XI. Se presumirá que los organismos que cumplen los criterios fijados en las normas nacionales se ajustan a los citados requisitos. No obstante, el acto de designación resulta independiente de cualquier certificación o acreditación nacional y no queda vinculado por ellas.
3. Cuando se haya designado un organismo y se compruebe que tal organismo ya no satisface los requisitos establecidos en el anexo XI, el Ministerio de Sanidad y Política Social retirará la autorización, previo el correspondiente procedimiento administrativo, con audiencia del interesado, e informará de ello a la Comisión Europea y a los demás Estados miembros.
1. El organismo notificado comprobará que el producto satisface los requisitos esenciales contemplados en este real decreto y efectuará las tareas previstas en los procedimientos de evaluación de la conformidad elegidos por los fabricantes.
El organismo notificado emitirá los certificados correspondientes a los procedimientos de evaluación de la conformidad, así como las certificaciones sobre los sistemas de calidad solicitadas por los fabricantes de productos sanitarios.
2. La documentación correspondiente a los procedimientos de evaluación de la conformidad se redactará, al menos, en español. No obstante, el organismo notificado podrá aceptar la presentación en otra lengua de documentación científica o especializada que soporte parte de la evaluación de la conformidad.
El organismo notificado podrá exigir cualquier dato o información que juzgue necesario para establecer o mantener el certificado de conformidad, a la vista del procedimiento elegido.
3. En la evaluación de la conformidad de un producto, el organismo notificado tendrá en cuenta los resultados disponibles en virtud de operaciones de evaluación y verificación que hayan tenido lugar, en su caso, conforme a lo dispuesto en este real decreto, en una fase intermedia de fabricación.
4. Las decisiones adoptadas por el organismo notificado con arreglo a los anexos II, III, V y VI deberán especificar su período de validez, que no será nunca superior a cinco años, y podrán prorrogarse por períodos de una duración máxima de cinco años previa solicitud del fabricante y acuerdo del organismo notificado.
5. El organismo notificado informará a la Agencia Española de Medicamentos y Productos Sanitarios de todos los certificados expedidos, modificados, completados, suspendidos, retirados o denegados. Así mismo, informará a los demás organismos notificados de los certificados suspendidos, retirados o denegados, así como, previa petición, de los certificados expedidos. Además, previa petición, pondrá a su disposición toda la información adicional pertinente.
6. En caso de que un organismo notificado observe que el fabricante no cumple o que ha dejado de cumplir los requisitos pertinentes de este real decreto, o que no se hubiera debido expedir un certificado, suspenderá, someterá a restricciones o retirará el certificado expedido, teniendo presente el principio de proporcionalidad, a no ser que el fabricante garantice el cumplimiento de tales requisitos mediante la aplicación de medidas correctoras eficaces.
En los casos de suspensión, sometimiento a restricciones o retirada del certificado, o en los casos en que pudiera requerirse la intervención de la autoridad competente, el organismo notificado informará de los hechos a la Agencia Española de Medicamentos y Productos Sanitarios trasladando una copia de la decisión correspondiente. La Agencia Española de Medicamentos y Productos Sanitarios informará a los demás Estados miembros y a la Comisión Europea. La Agencia Española de Medicamentos y Productos Sanitarios mantendrá informadas a las comunidades autónomas de los certificados suspendidos o retirados.
7. Previa petición, el organismo notificado facilitará toda la información y documentación pertinentes, incluidos los documentos presupuestarios necesarios para que el Ministerio de Sanidad y Política Social verifique el cumplimiento de los requisitos del anexo XI.
Téngase en cuenta que los apartados 5 y 6 de este artículo se derogan con efectos a partir de los dieciocho meses después de la fecha posterior de las mencionadas en el apartado 3.d) del artículo 123, del Reglamento (UE) 2017/745 del Parlamento Europeo y del Consejo, de 5 de abril de 2017, según establece la disposición derogatoria única.1.a) del Real Decreto 192/2023, de 21 de marzo, Ref. BOE-A-2023-7416.
1. En el caso de los productos regulados en el artículo 5 apartado 3, los organismos notificados procederán conforme a lo establecido en el artículo anterior, evaluando así mismo el análisis de riesgo del fabricante y su estrategia de gestión de riesgo y, en particular:
a) La información facilitada por el fabricante.
b) La justificación del uso de tejidos o derivados de origen animal.
c) Los resultados de los estudios sobre la eliminación o la inactivación o los resultados de la investigación bibliográfica.
d) El control por parte del fabricante del origen de las materias primas, de los productos acabados y de los subcontratistas.
e) La necesidad de comprobar los aspectos relativos al origen de los materiales, incluidos los suministros por terceros.
2. Durante la evaluación del análisis del riesgo y la gestión del riesgo en el marco del procedimiento de evaluación de la conformidad, los organismos notificados deberán tener en cuenta el certificado de idoneidad EET expedido por la Dirección Europea de Calidad del Medicamento (en lo sucesivo, «certificado EET») para los materiales de partida, cuando exista.
3. Antes de expedir un certificado de examen CE de diseño o un certificado de examen CE de tipo, los organismos notificados deberán prestar la debida atención a cualquier comentario de la Agencia Española de Medicamentos y Productos Sanitarios recibido en un plazo de tres meses a partir de la fecha en la que se haya solicitado su opinión.
4. Excepto en el caso de productos para cuya elaboración se utilicen materiales de partida que dispongan del certificado EET al que se refiere el apartado 2, los organismos notificados nacionales recabarán, a través de la Agencia Española de Medicamentos y Productos Sanitarios, la opinión de las autoridades competentes de los demás Estados miembros sobre su evaluación y las conclusiones del análisis y gestión del riesgo de los tejidos o derivados que se pretendan incorporar al producto sanitario, con arreglo a lo establecido por el fabricante.
El organismo notificado, en sus actuaciones de evaluación de la conformidad y de certificación de sistemas de calidad previstas en este real decreto, seguirá el procedimiento siguiente:
1. El procedimiento se iniciará a solicitud del fabricante o de su representante autorizado en la Unión Europea, conforme lo indicado en el artículo 13. Para ello el organismo notificado establecerá los formularios correspondientes adecuados a cada procedimiento, así como la documentación técnica y de calidad a aportar en cada caso.
2. El organismo notificado y el fabricante o su representante autorizado fijarán de común acuerdo los plazos para la realización de los procedimientos, teniendo en cuenta la complejidad tecnológica de los productos y de los procesos industriales, el número y la localización geográfica de las instalaciones y el número de productos incluidos en el procedimiento.
La fijación de plazo formará parte de la validación de la solicitud y hasta que no se lleve a efecto no quedará admitido a trámite el procedimiento.
3. Si la solicitud o la documentación presentada no se ajustara a lo establecido, el organismo notificado requerirá al interesado para que, en el plazo de 10 días, subsane las deficiencias, indicándole que si así no lo hiciera se le tendrá por desistido de su petición. Este plazo podrá ampliarse a requerimiento del interesado si el organismo notificado considera esta ampliación justificada. Trascurrido el plazo sin que se produzca la subsanación, el organismo notificado comunicará el desistimiento al interesado.
4. El organismo notificado realizará las actuaciones oportunas para establecer o mantener el certificado de conformidad solicitado. En el curso del procedimiento podrá requerir cuantos datos o informaciones considere necesarios para decidir sobre dicha conformidad.
5. El organismo notificado podrá reconocer los informes técnicos sobre productos o sistemas de calidad emitidos por entidades competentes, tanto públicas como privadas, que hayan sido acreditadas previamente por el propio organismo notificado, y que se emitan en el ámbito y las condiciones establecidas en dicha acreditación.
6. La solicitud de los datos o informes suspenderá los plazos acordados hasta tanto obren en poder del organismo notificado. La falta de presentación de dichos datos o informes, transcurridos tres meses de su solicitud, producirá la caducidad del procedimiento y el archivo de las actuaciones, salvo que en ese plazo el organismo notificado haya autorizado, a petición motivada del solicitante, una prórroga de dicho plazo.
7. El organismo notificado comunicará al solicitante la decisión adoptada, remitiéndole los correspondientes certificados o bien desestimando su solicitud. En este último supuesto, la notificación contendrá la motivación de la decisión adoptada, así como las vías de alegación que contra la misma procedan. Contra las decisiones adoptadas por el organismo notificado, el interesado podrá manifestar su disconformidad, en el plazo de un mes, ante el propio organismo, quien, una vez revisadas las alegaciones, comunicará la decisión final al interesado en el mismo plazo.
En caso de persistir el desacuerdo, el interesado podrá manifestar su disconformidad, en el plazo de un mes, ante el titular del Ministerio de Sanidad y Política Social, el cual, previa instrucción del oportuno expediente con audiencia del interesado, resolverá en el plazo máximo de tres meses. Contra dicha resolución podrán interponerse los recursos que proceden conforme a lo establecido en los artículos 116 y 117 de la Ley 30/1992, de 26 de noviembre.
8. Lo previsto en el apartado anterior será también de aplicación en el caso de las decisiones adoptadas por el organismo notificado de acuerdo con lo previsto en el artículo 19, apartado 6.
Téngase en cuenta que este artículo se mantiene vigente hasta el desarrollo de su legislación específica, según establece la disposición derogatoria única.1.a) del Real Decreto 192/2023, de 21 de marzo, Ref. BOE-A-2023-7416.
1. Cualquier persona física o jurídica que ponga por primera vez a disposición, para su distribución y/o utilización en territorio español, un producto de la clase IIa, IIb o III, efectuará una comunicación a la Agencia Española de Medicamentos y Productos Sanitarios, en el momento en que haga efectiva dicha puesta a disposición.
2. La Agencia Española de Medicamentos y Productos Sanitarios mantendrá actualizado un registro con todas las comunicaciones a que se refiere el apartado anterior.
3. Así mismo cualquier persona física o jurídica que comercialice productos sanitarios deberá mantener un registro documentado de los productos que ponga a disposición en territorio español que contendrá, al menos, los datos siguientes:
a) Nombre comercial del producto.
b) Modelo.
c) Número de serie o número de lote.
d) Fecha de envío o suministro.
e) Identificación del cliente.
Téngase en cuenta que este artículo se deroga con efectos a partir de los dieciocho meses después de la fecha posterior de las mencionadas en el apartado 3.d) del artículo 123, del Reglamento (UE) 2017/745 del Parlamento Europeo y del Consejo, de 5 de abril de 2017, según establece la disposición derogatoria única.1.a) del Real Decreto 192/2023, de 21 de marzo, Ref. BOE-A-2023-7416.
1. La comunicación contendrá los siguientes datos:
a) Datos identificativos de la persona que efectúa la comunicación.
b) Clase a la que pertenece el producto.
c) Nombre comercial del producto en España y nombres comerciales con los que se comercializa el producto en la Unión Europea, en caso de que sean diferentes al primero.
d) Categoría, tipo de producto y modelo/s.
e) Descripción y finalidad prevista del producto.
f) Datos identificativos del fabricante y del lugar de fabricación y de su representante autorizado, en su caso.
g) Número de identificación del organismo u organismos notificados que hayan intervenido en la evaluación de la conformidad a efectos de la colocación del marcado CE, anexos aplicados y copias de los certificados CE de conformidad.
h) Etiquetado e instrucciones de uso presentados al organismo notificado o certificados por el mismo.
i) Etiquetado e instrucciones de uso con los que se vaya a comercializar el producto en España, en la medida en que la versión española no se encuentre incluida en información señalada en la letra h). En este caso, la versión española será una traducción fiel de los presentados al organismo notificado o certificados por el mismo.
j) Fecha en la que se comercializa o se pone en servicio en España.
k) Datos identificativos de los distribuidores en España, en caso de que no coincidan con la persona señalada en la letra a).
2. Cualquier modificación de los datos señalados en el apartado anterior será comunicada siguiendo el procedimiento establecido en el artículo 22. También se comunicará cualquier modificación habida en los certificados, incluida su suspensión o retirada, así como el cese de la comercialización.
Téngase en cuenta que este artículo se deroga con efectos a partir de los dieciocho meses después de la fecha posterior de las mencionadas en el apartado 3.d) del artículo 123, del Reglamento (UE) 2017/745 del Parlamento Europeo y del Consejo, de 5 de abril de 2017, según establece la disposición derogatoria única.1.a) del Real Decreto 192/2023, de 21 de marzo, Ref. BOE-A-2023-7416.
1. Todo fabricante establecido en España que ponga en el mercado productos de la clase I, así como productos a medida, o que realice las actividades contempladas en el artículo 14, efectuará una comunicación a la Agencia Española de Medicamentos y Productos Sanitarios para que sea incluido en el Registro de Responsables de la puesta en el mercado que mantiene la misma, donde constará la dirección de su domicilio social y la descripción de los productos de que se trate. Esta obligación se hará extensiva al representante autorizado cuando se encuentre establecido en España.
2. Cualquier modificación de los datos señalados en el apartado anterior será comunicada siguiendo el procedimiento establecido en este artículo. También se comunicará el cese de la puesta en mercado de los productos.
3. La Agencia Española de Medicamentos y Productos Sanitarios informará, previa solicitud, a los demás Estados miembros y a la Comisión Europea de los datos facilitados por el fabricante o el representante autorizado contemplados en el presente artículo.
Téngase en cuenta que este artículo se deroga con efectos a partir de los dieciocho meses después de la fecha posterior de las mencionadas en el apartado 3.d) del artículo 123, del Reglamento (UE) 2017/745 del Parlamento Europeo y del Consejo, de 5 de abril de 2017, según establece la disposición derogatoria única.1.a) del Real Decreto 192/2023, de 21 de marzo, Ref. BOE-A-2023-7416.
La Agencia Española de Medicamentos y Productos Sanitarios facilitará el acceso a los registros previstos en los artículos 22 y 24, a las autoridades sanitarias competentes de las comunidades autónomas.
Téngase en cuenta que este artículo se deroga con efectos a partir de los dieciocho meses después de la fecha posterior de las mencionadas en el apartado 3.d) del artículo 123, del Reglamento (UE) 2017/745 del Parlamento Europeo y del Consejo, de 5 de abril de 2017, según establece la disposición derogatoria única.1.a) del Real Decreto 192/2023, de 21 de marzo, Ref. BOE-A-2023-7416.
1. Cuando un fabricante que ponga en el mercado en su propio nombre un producto, carezca de domicilio social en un Estado miembro, deberá designar un representante autorizado único en la Unión Europea. Esta designación se mantendrá a disposición de las autoridades competentes.
2. El fabricante o su representante autorizado deberá conservar la declaración de conformidad y la documentación prevista en los anexos que aplique, así como las decisiones, informes y certificados de los organismos notificados, a disposición de las autoridades sanitarias competentes, a efectos de control, durante un periodo de cinco años contados a partir de la fecha de fabricación del último producto. En el caso de productos implantables este periodo será de 15 años.
3. Los fabricantes, sus representantes autorizados, los importadores y los distribuidores deberán:
a) Presentar en español, ante un requerimiento motivado de las autoridades sanitarias, cuanta información se considere necesaria para juzgar sobre la conformidad de un producto. No obstante, podrá aceptarse la presentación de documentación que soporte dicha conformidad en otra/s lenguas que puedan comprender fácilmente dichas autoridades. La negativa a facilitar la documentación señalada en este artículo podrá considerarse como presunción de no conformidad.
En el caso de que el importador o el distribuidor no dispusieran de la documentación señalada en el apartado anterior la recabarán del fabricante o del representante autorizado.
b) Poner fin a la situación de infracción en las condiciones establecidas por las autoridades sanitarias de forma inmediata, cuando se trate de un producto en el que no figure el marcado CE en contra de lo establecido en este real decreto, o se constate su colocación indebida, o en los casos de no conformidad.
c) Satisfacer los gastos derivados de la comprobación de la no conformidad de un producto por las autoridades sanitarias, cuando esta requiera la realización de evaluaciones o ensayos sobre el producto o su documentación técnica. Deberán facilitar igualmente las muestras necesarias para efectuar tal comprobación.
d) Ejecutar cualquier medida de restricción de la puesta en el mercado, la comercialización, o la puesta en servicio de los productos, así como su retirada del mercado, recuperación de los usuarios o cualquier medida de seguimiento de la utilización de los productos que resulte adecuada, así como aquellas que, en su caso, puedan ser determinadas por las autoridades sanitarias, en caso de sospecha o evidencia de riesgo para la salud. Deberán cooperar con las autoridades en la adopción de tales medidas.
e) Identificar, a petición de las autoridades sanitarias, a cualquier agente que les haya suministrado el producto, a cualquier agente al que hayan suministrado el producto, y a los centros sanitarios a los que hayan suministrado directamente los productos. Estas obligaciones se mantendrán durante un periodo de cinco años a partir de la fecha de fabricación o suministro del último producto. En el caso de productos implantables este periodo será de quince años.
4. Los importadores, antes de introducir un producto, se asegurarán de que el producto posee el marcado CE, si procede, y de que el fabricante ha designado un representante en la Unión Europea, ha llevado a cabo la correspondiente evaluación de la conformidad y ha elaborado la documentación técnica requerida. Garantizarán que el producto va acompañado de los datos e informaciones especificados en el artículo 4, apartado 2, tanto en el etiquetado, como en las instrucciones de utilización, tal como se establece en el citado artículo.
5. Los distribuidores establecidos en territorio español, antes de distribuir un producto, se asegurarán de que el producto posee el marcado CE, si procede, y que va acompañado de los datos e informaciones especificados en el artículo 4, apartado 2, tanto en el etiquetado como en las instrucciones de utilización, tal como se establece en el citado artículo.
6. De acuerdo con lo establecido en el artículo 32, el importador y el distribuidor deberán cerciorarse de que se cumplen las obligaciones de notificación establecidas en el artículo citado, y, en caso necesario, proceder a la notificación correspondiente.
En el caso de que recibieran directamente de los centros sanitarios la comunicación de los casos señalados en dicho artículo, deberán ponerlo en conocimiento inmediato del fabricante y acordar con él los detalles de la notificación a la Agencia Española de Medicamentos y Productos Sanitarios.
1. Actividades de distribución y venta:
a) Únicamente podrán ser objeto de distribución y venta los productos que cumplan lo establecido en este real decreto, y que no estén caducados, tomando como referencia para esto último la fecha indicada en la letra e) de apartado 13.3 del anexo I.
b) La distribución y venta de los productos se efectuará en establecimientos que garanticen el adecuado almacenamiento y conservación de los productos.
c) Los establecimientos de distribución y venta estarán sometidos a la vigilancia e inspección de las autoridades sanitarias de la comunidad autónoma correspondiente.
d) Las personas físicas o jurídicas que se dediquen a dichas actividades, deberán realizar una previa comunicación de inicio de actividad a las autoridades sanitarias de la comunidad autónoma, que contendrá:
1.º Identificación del establecimiento de distribución o venta.
2.º Tipos de productos que distribuye o vende.
3.º Identificación y cualificación del técnico responsable previsto en el apartado 2.b), cuando proceda.
Quedan exceptuadas de realizar tal declaración de actividad las oficinas de farmacia, salvo que realicen las actividades contempladas en el apartado 3, en cuyo caso seguirán lo dispuesto en dicho apartado.
e) Podrá efectuarse la venta a través de máquinas expendedoras diseñadas al efecto, siempre que no resulte perjudicada la integridad y seguridad del producto, salvo en los casos de productos que requieran adaptación individualizada.
f) La venta al público por correspondencia y por procedimientos telemáticos se ajustará a lo previsto en el artículo 2.5 de la Ley 29/2006, de 26 de julio.
g) Queda prohibida la venta ambulante.
2. Establecimientos de distribución:
a) Los establecimientos de distribución contarán con la organización y medios precisos para adoptar cualquier medida que resulte adecuada en casos de riesgos potenciales relacionados con los productos. Contarán con un registro documentado de los productos que distribuya, que contendrá, al menos, los datos siguientes:
1.º Nombre comercial del producto.
2.º Modelo.
3.º Número de lote o número de serie.
4.º Fecha de envío o suministro.
5.º Identificación del cliente.
b) Las actividades de distribución se realizarán bajo la supervisión de un técnico responsable cuya titulación acredite una cualificación adecuada, que tendrá directamente a su cargo la ejecución de las actividades y obligaciones previstas en el artículo 22, cuando corresponda. Así mismo, será responsable de mantener la información técnico-sanitaria sobre los productos que distribuya o ponga en servicio en España.
3. Establecimientos de venta de productos que requieren adaptación individualizada:
a) Los establecimientos que realicen la venta al público de productos que requieran una adaptación individualizada, deberán contar con el equipamiento necesario para realizar tal adaptación y disponer de un profesional cuya titulación acredite una cualificación adecuada para estas funciones. En el caso de productos ortopédicos, a los efectos de determinar esta cualificación, se tendrá en cuenta lo dispuesto en el apartado 1 de la disposición final primera.
b) Antes de iniciar la actividad, los establecimientos deberán solicitar y obtener la autorización de la autoridad sanitaria de la comunidad autónoma donde estén establecidos, una vez que ésta haya comprobado que reúnen los requisitos señalados en el apartado anterior. A estos efectos, presentarán los datos necesarios del establecimiento, del profesional cualificado y del equipamiento correspondiente.
1. Los productos introducidos desde países comunitarios y los importados de terceros países sólo podrán comercializarse y ponerse en servicio en España si cumplen las prescripciones establecidas en este real decreto.
2. La Agencia Española de Medicamentos y Productos Sanitarios, a través de los servicios de inspección de las áreas funcionales de sanidad de las Delegaciones del Gobierno, verificará que las importaciones de productos sanitarios cumplan los siguientes requisitos:
a) Que el importador posea la licencia sanitaria de funcionamiento prevista en el artículo 9 de este real decreto.
b) Que el producto posea el marcado CE, salvo que se trate de productos a medida o productos destinados a investigaciones clínicas.
c) Que el producto haya sido objeto de los procedimientos de evaluación de la conformidad previstos en este real decreto.
En el caso de las importaciones de productos semielaborados, se comprobará que vayan destinadas a empresas que posean la licencia de funcionamiento como fabricantes prevista en el artículo 9.
3. Cuando no se cumplan las condiciones citadas en el apartado anterior, se procederá al rechazo de la mercancía.
Igualmente se procederá al rechazo de la mercancía cuando el producto posea un marcado CE indebido o falso, cuando el producto haya sido objeto de medidas de restricción por las autoridades sanitarias o cuando presente un riesgo para la salud.
4. Las áreas funcionales de sanidad informarán a la Agencia Española de Medicamentos y Productos Sanitarios de las operaciones de importación rechazadas.
5. La Agencia Española de Medicamentos y Productos Sanitarios podrá autorizar, por motivos justificados, importaciones de productos en las que no se reúnan las condiciones indicadas en el apartado 2.
Los productos que se fabriquen con destino exclusivo para la exportación a países no comunitarios y no cumplan los requisitos expuestos en este real decreto deberán ser etiquetados de forma que se identifiquen como tales inequívocamente, diferenciándose de los destinados al mercado comunitario, con objeto de evitar su utilización en el mismo.
1. En la realización de investigaciones clínicas con productos sanitarios se aplicarán los principios éticos, metodológicos y de protección de los sujetos del ensayo, contemplados en el Real Decreto 223/2004, de 6 de febrero, por el que se regulan los ensayos clínicos con medicamentos, así como lo establecido en el anexo X de este real decreto.
En el caso de que las investigaciones clínicas se realicen con productos que ostenten el marcado CE, no les resultará de aplicación el artículo 31, salvo que dichas investigaciones tengan por objeto utilizar los productos en una indicación diferente de la contemplada en el procedimiento pertinente de evaluación de la conformidad. Seguirán siendo aplicables las disposiciones correspondientes del anexo X, con excepción de su apartado 3.
2. Los productos destinados a investigación clínica solo podrán ser puestos a disposición de los facultativos si la investigación cuenta con el dictamen favorable del Comité Ético de Investigación Clínica acreditado por el órgano competente de la comunidad autónoma, de acuerdo con lo establecido en el artículo 60 de la Ley 29/2006, de 26 de julio. También será necesaria la conformidad de la dirección del centro donde vaya a realizarse.
Esta previsión se extenderá a las modificaciones de investigaciones clínicas en curso que puedan suponer un aumento de riesgo para los sujetos participantes en el ensayo.
3. La Agencia Española de Medicamentos y Productos Sanitarios mantendrá actualizado un registro con todas las investigaciones clínicas comunicadas. Dicho registro estará a disposición de las autoridades sanitarias competentes de las comunidades autónomas.
4. La Agencia Española de Medicamentos y Productos Sanitarios adoptará las medidas adecuadas para garantizar la salud y el orden público. Cuando una investigación clínica se deniegue o suspenda, la Agencia Española de Medicamentos y Productos Sanitarios comunicará su decisión y la razones en las que se basa a la Comisión Europea y a todos los Estados miembros.
En el caso de que la Agencia Española de Medicamentos y Productos Sanitarios solicite una modificación significativa o una suspensión temporal de una investigación clínica, informará a los Estados miembros afectados sobre estas acciones y las razones en las que se basan las medidas adoptadas.
5. El promotor informará a la Agencia Española de Medicamentos y Productos Sanitarios cuando se produzca la finalización de la investigación clínica. En caso de finalización anticipada, el promotor deberá presentar una justificación. Si la finalización anticipada de la investigación clínica fuese por razones de seguridad, esta notificación se transmitirá a la Comisión Europea y a todos los Estados miembros. El promotor deberá mantener a disposición de las autoridades competentes el informe al que se refiere el punto 2.3.7 del anexo X.
6. La Agencia Española de Medicamentos y Productos Sanitarios informará a las comunidades autónomas correspondientes de las decisiones que se adopten para garantizar la seguridad de las investigaciones clínicas.
Téngase en cuenta que este artículo se deroga con efectos a partir de la fecha posterior de las mencionadas en el apartado 3.d) del artículo 123, del Reglamento (UE) 2017/745 del Parlamento Europeo y del Consejo, de 5 de abril de 2017, según establece la disposición derogatoria única.1.a) del Real Decreto 192/2023, de 21 de marzo, Ref. BOE-A-2023-7416.
1. Al menos 60 días antes del comienzo de las investigaciones, el promotor solicitará la autorización correspondiente a la Agencia Española de Medicamentos y Productos Sanitarios, acompañando la documentación señalada en el apartado 2.2 del anexo VIII. Esta solicitud se realizará sin perjuicio de la comunicación que, en su caso, sea exigida por la autoridad sanitaria de la comunidad autónoma correspondiente.
2. La Agencia Española de Medicamentos y Productos Sanitarios verificará que la solicitud reúne los requisitos previstos en el párrafo anterior y notificará al solicitante su admisión a trámite.
En el caso de que la solicitud o la documentación presentada no reúnan los requisitos establecidos, se requerirá al solicitante para que subsane las deficiencias en el plazo máximo de 10 días, con indicación de que si así no lo hiciera se le tendrá por desistido de su petición. Transcurrido el plazo sin que se produzca la subsanación, la Agencia Española de Medicamentos y Productos Sanitarios resolverá, comunicando el desistimiento al interesado.
3. La Agencia Española de Medicamentos y Productos Sanitarios evaluará la documentación presentada y resolverá autorizando las investigaciones o comunicando una decisión en contra basada en consideraciones de salud pública o de orden público. Podrán iniciarse las investigaciones si transcurridos 60 días desde la notificación de admisión a trámite de la solicitud, la Agencia Española de Medicamentos y Productos Sanitarios no hubiese comunicado objeciones motivadas al solicitante, siempre que se cuente con el informe favorable del Comité Ético de Investigación Clínica acreditado correspondiente sobre el programa de investigación de que se trate, incluida la revisión del plan de investigación clínica, así como de la conformidad de la dirección del centro donde vaya a realizarse la investigación.
4. Si se precisa información complementaria, se solicitará por escrito al solicitante. El plazo de 60 días se suspenderá en la fecha de emisión del escrito y se reanudará a partir de la fecha de entrada en la Agencia Española de Medicamentos y Productos Sanitarios de la última información solicitada.
La falta de presentación de la información solicitada transcurridos tres meses de su solicitud producirá la caducidad del procedimiento y el archivo de las actuaciones, salvo que en ese plazo la Agencia Española de Medicamentos y Productos Sanitarios haya autorizado, a petición motivada del solicitante, una prórroga de dicho plazo.
5. No obstante lo dispuesto en el apartado 3, en el caso de productos distintos a los de la clase III o a los implantables o invasivos de uso prolongado de las clases IIa o IIb, podrán iniciarse las investigaciones clínicas si transcurrido un mes desde la notificación de admisión a trámite de la solicitud, la Agencia Española de Medicamentos y Productos Sanitarios no hubiese comunicado objeciones motivadas al solicitante, siempre que se cuente con el informe favorable del Comité Ético de Investigación Clínica correspondiente, sobre el programa de investigación de que se trate, incluida la revisión del plan de investigación clínica, así como de la conformidad del director del centro en que van a llevarse a cabo dichas investigaciones.
6. Toda modificación de una investigación clínica deberá comunicarse según el procedimiento anterior.
Téngase en cuenta que este artículo se deroga con efectos a partir de la fecha posterior de las mencionadas en el apartado 3.d) del artículo 123, del Reglamento (UE) 2017/745 del Parlamento Europeo y del Consejo, de 5 de abril de 2017, según establece la disposición derogatoria única.1.a) del Real Decreto 192/2023, de 21 de marzo, Ref. BOE-A-2023-7416.
1. Los fabricantes, o, en su defecto, los representantes autorizados, importadores o distribuidores, deberán enviar una notificación a la Agencia Española de Medicamentos y Productos Sanitarios sobre los siguientes hechos tan pronto tengan conocimiento de los mismos, así como sobre las medidas correctoras que procedan:
a) Cualquier funcionamiento defectuoso o alteración de las características o de las prestaciones del producto, así como cualquier inadecuación del etiquetado o de las instrucciones de utilización que pueda dar lugar o haya podido dar lugar a la muerte o al deterioro grave del estado de salud de un paciente o de un usuario.
b) Cualquier razón de carácter técnico o sanitario ligada a las características o prestaciones de un producto que, por los motivos mencionados en la letra anterior, haya inducido al fabricante a realizar una acción sistemática sobre los productos del mismo tipo.
2. La obligación de notificar se aplicará, igualmente, a los profesionales sanitarios y a las autoridades que, con ocasión de su actividad, tuvieran conocimiento de los hechos mencionados en la letra a) del apartado anterior. La Agencia Española de Medicamentos y Productos Sanitarios informará al fabricante del producto afectado o a su representante autorizado.
Los centros sanitarios designarán un responsable de vigilancia para los procedimientos que se deriven de la aplicación de este artículo, el cual supervisará igualmente el cumplimiento de las obligaciones establecidas en el artículo 33 en relación con las tarjetas de implantación. Comunicarán sus datos a las autoridades sanitarias de la correspondiente comunidad autónoma y a la Agencia Española de Medicamentos y Productos Sanitarios. Los centros sanitarios pertenecientes a la Red Sanitaria de la Defensa efectuarán dicha comunicación a través de la Inspección General de Sanidad de la Defensa, quien la trasladará a la Agencia Española de Medicamentos y Productos Sanitarios y a las autoridades sanitarias de la correspondiente comunidad autónoma.
3. Las citadas notificaciones se realizarán sin perjuicio de las que, en su caso, sean requeridas por las autoridades sanitarias de la comunidad autónoma correspondiente.
4 La Agencia Española de Medicamentos y Productos Sanitarios evaluará y registrará de forma centralizada las notificaciones, adoptando las medidas necesarias de protección de la salud, conforme a lo establecido en el artículo 35.
5. Evaluada la notificación, cuando sea posible conjuntamente con el fabricante o su representante autorizado, la Agencia Española de Medicamentos y Productos Sanitarios informará inmediatamente a la Comisión Europea y al resto de Estados miembros sobre las medidas adoptadas o previstas para minimizar la repetición de los incidentes notificados, incluyendo la información relativa a tales incidentes.
6. La Agencia Española de Medicamentos y Productos Sanitarios dará conocimiento a las autoridades sanitarias de las comunidades autónomas y a la Inspección General de Sanidad de la Defensa de la información relativa a las medidas adoptadas o que corresponda adoptar en relación con los incidentes notificados. Igualmente dará conocimiento a otros agentes afectados en los casos en que resulte oportuno.
7. Cualquier información de un fabricante, representante autorizado, importador o distribuidor destinada a comunicar medidas de prevención, retirada u otras acciones correctivas, así como cualquier advertencia relacionada con productos comercializados deberá ser facilitada en español y deberá ser puesta en conocimiento de la Agencia Española de Medicamentos y Productos Sanitarios antes de su difusión. La Agencia Española de Medicamentos y Productos Sanitarios podrá determinar la conveniencia de ejecutar las medidas propuestas, impidiéndolas o modificándolas por razones justificadas de salud pública.
Téngase en cuenta que este artículo se deroga con efectos a partir de la fecha posterior de las mencionadas en el apartado 3.d) del artículo 123, del Reglamento (UE) 2017/745 del Parlamento Europeo y del Consejo, de 5 de abril de 2017, según establece la disposición derogatoria única.1.a) del Real Decreto 192/2023, de 21 de marzo, Ref. BOE-A-2023-7416.
1. Los implantes relacionados a continuación que se distribuyan en España deberán ir acompañados de una tarjeta de implantación:
a) Implantes cardíacos e implantes vasculares del sistema circulatorio central.
b) Implantes del sistema nervioso central.
c) Implantes de columna vertebral.
d) Prótesis de cadera.
e) Prótesis de rodilla.
f) Prótesis mamarias.
g) Lentes intraoculares.
2. La tarjeta de implantación, en triplicado ejemplar, incluirá al menos el nombre y modelo del producto, el número de lote o número de serie, el nombre y dirección del fabricante, el nombre del centro sanitario donde se realizó la implantación y la fecha de la misma, así como la identificación del paciente (documento nacional de identidad, número de pasaporte), y será cumplimentada por el hospital tras la implantación.
Uno de los ejemplares permanecerá archivado en la historia clínica del paciente, otro será facilitado al paciente y el tercero será remitido a la empresa suministradora. En el caso en que se haya dispuesto de un registro nacional de implantes, una copia de este último ejemplar será remitida al registro nacional por la empresa suministradora.
3. La inclusión de la información contenida en la tarjeta en la historia clínica o su remisión a la empresa suministradora o al Registro Nacional de Implantes podrá efectuarse por medios electrónicos, siempre que el sistema utilizado posea las debidas garantías para que esta información se utilice a los solos efectos previstos en este artículo.
4. La Agencia Española de Medicamentos y Productos Sanitarios tendrá acceso a los datos contenidos en las tarjetas a los fines establecidos en la Orden SCO/3603/2003, de 18 de diciembre, por la que se crean los Registros Nacionales de Implantes.
Téngase en cuenta que este artículo se mantiene vigente mientras que los productos se sigan introduciendo en el mercado y comercializando de acuerdo a lo establecido en los apartados 3 y 4 del artículo 120 del Reglamento (UE) 2017/745 del Parlamento Europeo y del Consejo, de 5 de abril de 2017, según establece la disposición derogatoria única.1.a) del Real Decreto 192/2023, de 21 de marzo, Ref. BOE-A-2023-7416.
1. Corresponde a las administraciones sanitarias, en el ámbito de sus competencias, la realización de inspecciones periódicas para verificar que se cumple lo establecido en este real decreto.
2. La vulneración de las previsiones que establece este real decreto dará lugar a la adopción, por dichas autoridades, de las medidas correctoras precisas, con independencia de las sancionadoras que procedieran.
3. La Agencia Española de Medicamentos y Productos Sanitarios, por sí misma o a través de los servicios de inspección de las áreas de sanidad de las Delegaciones del Gobierno, ejercerá actividades de inspección y control respecto de los productos de comercio exterior y de los establecimientos en los que se fabriquen, importen o exporten, siempre que estén situados en territorio nacional, así como en los demás supuestos previstos en el artículo 98, apartado 2, de la Ley 29/2006, de 26 de julio.
4. El personal al servicio de las Administraciones públicas que desarrolle las funciones de inspección procederá según lo establecido en el artículo 98, apartado 3, de la Ley 29/2006, de 26 de julio, y podrá solicitar cuanta información resulte necesaria para verificar el cumplimiento de lo dispuesto en este real decreto por los productos comercializados en España y por los sometidos a investigación clínica.
5. Las autoridades de la Administración General del Estado y de las comunidades autónomas competentes se auxiliarán mutuamente a efectos de inspección.
La Agencia Española de Medicamentos y Productos Sanitarios adoptará las medidas adecuadas para favorecer la cooperación y asistencia mutua con las autoridades sanitarias de las comunidades autónomas, incluida la organización de programas específicos de control.
1. La Agencia Española de Medicamentos y Productos Sanitarios y las demás autoridades sanitarias competentes, cuando consideren que un producto sanitario, un producto a medida o un grupo de productos determinados, correctamente instalados, mantenidos y utilizados conforme a su finalidad prevista, puedan comprometer la salud y/o la seguridad de los pacientes, usuarios o la de terceras personas, procederán a adoptar las medidas cautelares adecuadas previstas en el artículo 26 de la Ley 14/1986, de 25 de abril, y en el artículo 99 de la Ley 29/2006, de 26 de julio.
2. En el caso de que la medida haya sido adoptada por una autoridad sanitaria distinta a la Agencia Española de Medicamentos y Productos Sanitarios, aquélla deberá informar de forma inmediata a este organismo de la medida adoptada, así como de las razones que la hayan motivado.
3. La Agencia Española de Medicamentos y Productos Sanitarios comunicará inmediatamente a la Comisión Europea las medidas que se hayan adoptado, indicando las razones, y, en particular, si esta decisión se debe a:
a) El incumplimiento de los requisitos esenciales.
b) La incorrecta aplicación de las normas o monografías contempladas en el artículo 6, en el caso de que se afirme que se han aplicado dichas normas.
c) Una laguna en las mencionadas normas.
4. Cuando un producto no conforme ostente el marcado CE, haya sido objeto de un marcado CE indebido o dicho marcado CE no figure debiendo figurar, en contra de lo previsto en este real decreto, la Agencia Española de Medicamentos y Productos Sanitarios y las demás autoridades sanitarias competentes adoptarán las medidas apropiadas contra el fabricante, el representante autorizado, el importador o el distribuidor, según corresponda.
En el caso de que la medida haya sido adoptada por una autoridad sanitaria distinta de la Agencia Española de Medicamentos y Productos Sanitarios, aquélla lo pondrá en conocimiento de este organismo. La Agencia Española de Medicamentos y Productos Sanitarios comunicará a la Comisión Europea y al resto de Estados miembros las medidas adoptadas cuando el tipo de no conformidad pueda ser relevante para otros Estados miembros.
5. La Agencia Española de Medicamentos y Productos Sanitarios dará conocimiento de las medidas adoptadas por los medios idóneos, y con la rapidez adecuada a cada caso, a las autoridades sanitarias, los servicios sanitarios, las entidades responsables o el público en general, según proceda. El coste de dichas medidas será sufragado por la persona física o jurídica que hubiera dado lugar a su adopción.
Cuando la Agencia Española de Medicamentos y Productos Sanitarios considere, respecto de un producto o un grupo de productos determinado, que, para garantizar la protección de la salud de las personas, la seguridad o el cumplimiento de las normas de salud pública, tales productos deban retirarse del mercado o que su puesta en el mercado o puesta en servicio deban prohibirse, restringirse o someterse a condiciones especiales, podrá adoptar todas las medidas necesarias y transitorias que estén justificadas, de lo que informará a la Comisión Europea y a los otros Estados miembros indicando los motivos de su decisión.
Por los mismos motivos podrá dictar disposiciones sobre condiciones de utilización de los productos o sobre medidas de seguimiento especial y hacer incluir las advertencias necesarias para evitar riesgos sanitarios en la utilización de los productos.
A las medidas adoptadas con arreglo a este artículo les será de aplicación lo dispuesto en el apartado 5 del artículo 35.
1. Cualquier medida adoptada de acuerdo con los dos artículos anteriores deberá ser previamente puesta en conocimiento del interesado, salvo que concurran razones de urgencia para su adopción.
2. Cuando por aplicación de este real decreto se rechace o restrinja la puesta en el mercado y/o la puesta en servicio de un producto o la realización de una investigación clínica, así como cuando se realice la retirada de un producto del mercado, o se proceda al rechazo de una importación, el interesado podrá manifestar su disconformidad ante el órgano superior jerárquico del que dictó la resolución mediante el correspondiente recurso, de acuerdo con lo establecido en el artículo 114 y siguientes de la Ley 30/1992, de 26 de noviembre.
1. La publicidad y promoción de los productos regulados en este real decreto se regirá por los principios generales establecidos en la Ley 34/1988, de 11 de noviembre, General de Publicidad, así como en los artículos 27 y 102 de la Ley 14/1986, de 25 de abril, y en la Ley 29/2006, de 26 de julio.
2. Los fabricantes, distribuidores o comercializadores, así como todas aquellas entidades que puedan mantener un contacto directo con el paciente, no podrán hacer publicidad directa o indirecta dirigida al público, en el caso de que el producto sanitario esté financiado por el Sistema Nacional de Salud.
3. Los medios de información y promoción utilizados como soporte, ya sean escritos, audiovisuales o de otra naturaleza, tendrán carácter básicamente científico y estarán dirigidos y se distribuirán con carácter general a profesionales sanitarios.
4. La información se facilitará a través de personas adecuadamente formadas y que posean los conocimientos suficientes para proporcionar orientaciones precisas y completas sobre los productos que promocionan. El contenido de la información incluirá los datos técnicos necesarios para que se pueda juzgar objetivamente sobre la utilidad del producto sanitario.
5. En el caso de que, por la naturaleza del producto sanitario, se efectúe publicidad directa al público, se tendrá en cuenta, en particular, lo establecido en el artículo 78, apartado 5 de la Ley 29/2006, de 26 de julio, así como las disposiciones de este real decreto.
6. Los mensajes publicitarios que se inserten en cualquiera de los medios generales de comunicación, incluido Internet, así como cualquier otro material promocional dirigido al público, serán objeto de autorización previa por las autoridades sanitarias de las comunidades autónomas. Cualquier otro texto promocional estará a disposición de las autoridades sanitarias citadas durante, al menos, tres meses después de su divulgación.
A los efectos indicados en este apartado, actuará la comunidad autónoma donde tenga su domicilio la empresa del producto anunciado, salvo que la publicidad esté destinada, exclusivamente, al territorio de una comunidad autónoma, que será, en este caso, la responsable de su autorización. Cuando la empresa carezca de domicilio en España, actuará la comunidad autónoma donde radique el medio de difusión.
7. Los textos de publicidad o promoción deberán indicar la conformidad del producto con la legislación vigente, así como las contraindicaciones y los posibles efectos secundarios que pudieran derivarse del uso de los productos.
8. En la publicidad de los productos dirigida al público se prohíbe cualquier mención que haga referencia a una autoridad sanitaria o a recomendaciones que hayan formulado científicos, profesionales de la salud u otras personas que puedan, debido a su notoriedad, incitar a su utilización. Se exceptúa de esta prohibición la publicidad promovida por las Administraciones públicas.
9. Queda prohibido efectuar publicidad dirigida al público de los productos que sean aplicados o utilizados directamente por dichos profesionales, así como la publicidad de todo producto que sin ajustarse a lo establecido en este real decreto pretenda realizar alguno de los fines previstos en el artículo 2, apartado 1, letras a) y b).
Téngase en cuenta que este artículo se mantiene vigente hasta el desarrollo de su legislación específica, según establece la disposición derogatoria única.1.a) del Real Decreto 192/2023, de 21 de marzo, Ref. BOE-A-2023-7416.
De acuerdo con lo establecido en el artículo 3, apartado 6, de la Ley 29/2006, de 26 de julio, en el marco de la promoción de los productos sanitarios está prohibido otorgar, ofrecer o prometer primas, ventajas pecuniarias o ventajas en especie a los profesionales sanitarios que prescriben los productos, así como a sus parientes o personas con las que convivan.
Las personas relacionadas en el párrafo anterior no podrán solicitar o aceptar ninguno de los incentivos prohibidos.
Téngase en cuenta que este artículo se mantiene vigente hasta el desarrollo de su legislación específica, según establece la disposición derogatoria única.1.a) del Real Decreto 192/2023, de 21 de marzo, Ref. BOE-A-2023-7416.
1. Las disposiciones del artículo anterior no supondrán un obstáculo para la hospitalidad ofrecida, directa o indirectamente, en el marco de manifestaciones de carácter exclusivamente profesional y científico. Dicha hospitalidad deberá ser siempre moderada en su nivel y subordinada al objetivo principal de la reunión, y no podrá ser extenderse a personas que no sean profesionales de la salud.
2. Los premios, becas, contribuciones y subvenciones a reuniones, congresos, viajes de estudio y actos similares donados por personas relacionadas con la fabricación, elaboración, distribución y venta de los productos, se aplicarán exclusivamente a actividades de índole científica cuando sus destinatarios sean facultativos en ejercicio clínico o las entidades en que se asocian.
En las publicaciones de trabajos y ponencias de reuniones, congresos y actos similares se harán constar los fondos obtenidos para su realización y fuente de financiación. La misma obligación alcanzará al medio de comunicación por cuya vía se hagan públicos y que obtenga fondos por o para su publicación.
Téngase en cuenta que este artículo se mantiene vigente hasta el desarrollo de su legislación específica, según establece la disposición derogatoria única.1.a) del Real Decreto 192/2023, de 21 de marzo, Ref. BOE-A-2023-7416.
En las ferias, exposiciones y demostraciones podrán presentarse productos que no cumplan las disposiciones de este real decreto, siempre que en un cartel suficientemente visible, colocado en los propios productos o junto a ellos, se indique claramente que dichos productos no pueden ponerse en el mercado ni ponerse en servicio hasta que se declare su conformidad. Tales demostraciones no podrán nunca implicar la utilización de dichos productos en los pacientes.
(Derogado)
(Derogado)
A los procedimientos regulados en los artículos 9, 13, 14, 22 y 30 de este real decreto, les serán de aplicación las tasas correspondientes recogidas en el grupo VIII del artículo 111.1 de la Ley 29/2006, de 26 de julio, de garantías y uso racional de los medicamentos y productos sanitarios.
Los productos que incorporen tejidos o células de origen humano o deriven de ellos, contemplados en la letra f) del apartado 9 del artículo 3, se regirán:
a) Por el Reglamento (CE) n.º 1394/2007 del Parlamento Europeo y del Consejo, de 13 de noviembre de 2007, sobre medicamentos de terapia avanzada y por el que se modifican la Directiva 2001/83/CE y el Reglamento (CE) n.º 726/2004, cuando dichos tejidos o células sean viables.
b) Por el Real Decreto 1301/2006, de 10 de noviembre, por el que se establecen las normas de calidad y seguridad para la donación, la obtención, la evaluación, el procesamiento, la preservación, el almacenamiento y la distribución de células y tejidos humanos y se aprueban las normas de coordinación y funcionamiento para su uso en humanos, cuando dichos tejidos o células sean no viables.
Las referencias que se contienen en este real decreto a las comunidades autónomas, se entenderán realizadas a las ciudades autónomas de Ceuta y Melilla, en el marco de sus competencias.
Resultará de aplicación el capítulo VII de este real decreto «Comercio intracomunitario y exterior» a los productos sanitarios para diagnóstico «in vitro».
Téngase en cuenta que esta disposición se mantiene vigente hasta el desarrollo de su legislación específica, según establece la disposición derogatoria única.1.a) del Real Decreto 192/2023, de 21 de marzo, Ref. BOE-A-2023-7416.
El procedimiento para aplicar lo dispuesto en el capítulo II de este real decreto en las instalaciones de las Fuerzas Armadas se determinará conjuntamente entre la Agencia Española de Medicamentos y Productos Sanitarios y la Inspección General de Sanidad de la Defensa.
La Agencia Española de Medicamentos y Productos Sanitarios desarrollará e incluirá en el registro electrónico del Departamento procedimientos para que puedan llevarse a cabo por medios electrónicos las solicitudes, declaraciones y comunicaciones previstas en este real decreto y pondrá a disposición de los interesados los modelos normalizados y la información sobre los procedimientos.
1. Las prótesis de cadera, rodilla y hombro que hayan sido objeto del procedimiento de evaluación de la conformidad contemplado en el artículo 13.1.b).1.º antes del 1 de septiembre de 2007 estarán sujetos a una evaluación de la conformidad complementaria con arreglo al punto 4 del anexo II, que dará lugar a un certificado de examen CE de diseño antes del 1 de septiembre de 2009. A estos efectos, los fabricantes presentarán la solicitud correspondiente y abonarán la tasa aplicable.
Esta disposición no excluye que un fabricante pueda presentar una solicitud de evaluación de la conformidad con arreglo al procedimiento contemplado en el artículo 13.1.a).2.º
2. Las prótesis de cadera, rodilla y hombro que hayan sido objeto del procedimiento de evaluación de la conformidad contemplado en el artículo 13.1.b).2.º3.ª antes del 1 de septiembre de 2007 podrán estar sujetas a un procedimiento de evaluación de la conformidad como productos sanitarios de clase III con arreglo al artículo 13.1.a).2.º1.ª ó 2.ª, antes del 1 de septiembre de 2010. A estos efectos, los fabricantes presentarán la solicitud correspondiente y abonarán la tasa aplicable.
Esta disposición no excluye que un fabricante pueda presentar una solicitud de evaluación de la conformidad con arreglo al procedimiento contemplado en el artículo 13.1.a).1.º
1. Hasta el 1 de septiembre de 2009 podrán ponerse en el mercado y ponerse en servicio las prótesis de cadera, rodilla y hombro amparadas por una decisión basada en el procedimiento contemplado en el artículo 13.1.b).1.º emitida antes del 1 de septiembre de 2007.
2. Hasta el 1 de septiembre de 2010 podrán ponerse en el mercado las prótesis de cadera, rodilla y hombro amparadas por una decisión basada en el procedimiento contemplado en el artículo 13.1.b).2.º3.ª emitida antes del 1 de septiembre de 2007. Dichas prótesis podrán ponerse en servicio después de esa fecha.
La Agencia Española de Medicamentos y Productos Sanitarios determinará los plazos para efectuar la comunicación de comercialización y puesta en servicio de los productos sanitarios de clase IIa, puestos en el mercado español con anterioridad a la entrada en vigor de este real decreto. Esta comunicación quedará exenta del pago de la tasa correspondiente.
Los procedimientos de autorización, certificación y comunicación realizados con arreglo al Real Decreto 414/1996, de 1 de marzo, por el que se regulan los productos sanitarios conservan su validez.
Quedan derogadas cuantas disposiciones de igual o inferior rango se opongan a lo establecido en este real decreto, y en particular el Real Decreto 414/1996, de 1 de marzo, por el que se regula los productos sanitarios.
1. Sin perjuicio de lo establecido en la legislación específica sobre profesiones tituladas, las actividades de fabricación a medida de productos ortopédicos deberán realizarse bajo la supervisión de un técnico responsable titulado cuya titulación acredite una cualificación adecuada para estas funciones, de acuerdo con lo establecido en el artículo 3 apartado 3 del Real Decreto 437/2002, de 10 de mayo, por el que se establecen los criterios para la concesión de licencias de funcionamiento a los fabricantes de productos sanitarios a medida.
Estas actividades podrán también realizarse bajo la supervisión de un profesional que tuviera una experiencia mínima de tres años en la fecha de 14 de mayo de 1999, aunque no cuente con la titulación mencionada en el apartado anterior.
2. Lo señalado en el segundo párrafo del apartado anterior respecto a la experiencia será también de aplicación a las actividades de venta con adaptación individualizada de productos ortoprotésicos y audioprotésicos, en relación con la titulación del profesional recogida en el apartado 3 a) del artículo 27.
3. El desarrollo de las actividades correspondientes a la profesión de protésico dental se ajustará a lo dispuesto en la legislación reguladora de dicha profesión, sin perjuicio del cumplimiento de las obligaciones que como fabricantes de productos sanitarios les correspondan.
1. Se añaden tres apartados al artículo 13, con la siguiente redacción:
«6. Para la venta al público de los productos de autodiagnóstico se exigirá la correspondiente prescripción. Como excepción, esta prescripción no será necesaria en los productos para el diagnóstico del embarazo y de la fertilidad, así como en los productos de autodiagnóstico para la determinación de la glucemia.
7. Queda prohibida la venta al público por correspondencia o por procedimientos telemáticos de los productos de autodiagnóstico. No obstante, esta modalidad podrá efectuarse por las oficinas de farmacia, con la intervención de un farmacéutico y el asesoramiento correspondiente, para los productos en los que no es necesaria la correspondiente prescripción.
8. Por razones de salud pública, no se pondrán a disposición del público los productos para el diagnóstico genético.»
2. En el artículo 25 Publicidad y presentación de los productos se añade el siguiente apartado:
«8. Queda prohibido efectuar publicidad dirigida al público de los productos de autodiagnóstico, con excepción de los destinados al diagnóstico del embarazo y de la fertilidad. Igualmente queda prohibido efectuar publicidad dirigida al público de los productos para el diagnóstico genético.»
1. El artículo 3 apartado 3 de este real decreto tiene carácter de legislación sobre productos farmacéuticos conforme a lo establecido en el artículo 149.1.16.ª de la Constitución.
2. El capítulo VII se dicta al amparo de la competencia exclusiva del Estado para regular la sanidad exterior, de acuerdo con lo dispuesto en el artículo 149.1.16.ª de la Constitución.
3. El resto de disposiciones de este real decreto, tienen la condición de normas básicas en el sentido previsto en el artículo 149.1.16.ª de la Constitución, que atribuye al Estado la competencia para establecer las bases y la coordinación de la sanidad.
Mediante este real decreto se incorpora al derecho español la Directiva 2007/47/CE del Parlamento Europeo y del Consejo de 5 de septiembre de 2007, por la que se modifica la Directiva 90/385/CEE del Consejo, relativa a la aproximación de las disposiciones de los Estados miembros sobre los productos sanitarios implantables activos, la Directiva 93/42/CEE del Consejo, relativa a los productos sanitarios y la Directiva 98/8/CE, relativa a la comercialización de biocidas.
Se faculta al titular del Ministerio de Sanidad y Política Social para dictar cuantas disposiciones sean necesarias para la aplicación y desarrollo de este real decreto, así como para actualizar las relaciones de productos establecidas en el artículo 33 y para adoptar las disposiciones que, en relación con la clasificación o reclasificación de los productos sanitarios o la modificación o adaptación, en su caso, de las reglas de clasificación de estos productos, se adopten en el nivel comunitario o resulten aconsejables por razones técnicas o científicas.
El presente real decreto entrará en vigor el día 21 de marzo de 2010.
Dado en Madrid, el 16 de octubre de 2009.
JUAN CARLOS R.
La Ministra de Sanidad y Política Social,
TRINIDAD JIMÉNEZ GARCÍA-HERRERA
Téngase en cuenta que las obligaciones relativas a la vigilancia y las investigaciones clínicas previstas en los correspondientes anexos quedan derogadas con efectos a partir de la fecha posterior de las mencionadas en el apartado 3.d) del artículo 123, del Reglamento (UE) 2017/745 del Parlamento Europeo y del Consejo, de 5 de abril de 2017, y la notificación de certificados previstas en los correspondientes anexos quedan derogadas con efectos a partir de los dieciocho meses después de la fecha posterior de las mencionadas en el apartado 3.d) del artículo 123, del Reglamento (UE) 2017/745 del Parlamento Europeo y del Consejo, de 5 de abril de 2017, según establece la disposición derogatoria única.1.a) del Real Decreto 192/2023, de 21 de marzo, Ref. BOE-A-2023-7416.
I. Requisitos generales
1. Los productos deberán diseñarse y fabricarse de forma tal que su utilización no comprometa el estado clínico o la seguridad de los pacientes ni la seguridad y la salud de los usuarios, y en su caso, de otras personas cuando se utilizan en las condiciones y con las finalidades previstas. Los posibles riesgos asociados a la finalidad prevista deberán ser aceptables en relación con el beneficio que proporcionen al paciente y compatibles con un nivel elevado de protección de la salud y de la seguridad.
Esto implicará:
la reducción, dentro de lo posible, del riesgo derivado de errores de utilización debidos a las características ergonómicas del producto y al entorno en el que está previsto utilizar el producto (diseño que tenga en cuenta la seguridad del paciente), y
tener en cuenta los conocimientos técnicos, la experiencia, la formación, el adiestramiento y, en su caso, las condiciones médicas y físicas de los usuarios previstos (diseño para usuarios no profesionales, profesionales, con discapacidad u otros).
2. Las soluciones adoptadas por el fabricante en el diseño y la construcción de los productos deberán ajustarse a los principios de integración de la seguridad teniendo en cuenta el estado generalmente reconocido de la técnica.
Al seleccionar las soluciones más adecuadas el fabricante aplicará los siguientes principios, en el orden que se indica:
Eliminar o reducir los riesgos en la medida de lo posible (seguridad inherente al diseño y a la fabricación).
Adoptar las oportunas medidas de protección incluso alarmas, en caso de que fuesen necesarias, frente a los riesgos que no puedan eliminarse.
Informar a los usuarios de los riesgos residuales debidos a la incompleta eficacia de las medidas de protección adoptadas.
3. Los productos deberán ofrecer las prestaciones que les haya atribuido el fabricante y estarán diseñados, fabricados y acondicionados de forma que puedan desempeñar una o varias de las funciones contempladas en las letras a) o b), del apartado 1, del artículo 2, y tal y como el fabricante las haya especificado.
4. Las características y prestaciones referidas en los apartados 1, 2 y 3 no deberán alterarse en un grado tal que se vean comprometidos el estado clínico y la seguridad de los pacientes ni en su caso, de terceros, mientras dure el período de validez previsto por el fabricante, cuando el producto se vea sometido a las situaciones que puedan derivarse de las condiciones normales de utilización.
5. Los productos deberán diseñarse, fabricarse y acondicionarse de forma tal que sus características y prestaciones, según su utilización prevista, no se vean alteradas durante el almacenamiento y transporte, teniendo en cuenta las instrucciones y datos facilitados por el fabricante.
6. Cualquier efecto secundario no deseado deberá constituir un riesgo aceptable en relación con las prestaciones atribuidas.
6 bis. La demostración de la conformidad con los requisitos esenciales debe incluir una evaluación clínica con arreglo al anexo X.
II. Requisitos relativos al diseño y a la fabricación
7. Propiedades químicas, físicas y biológicas.
7.1 Los productos deberán diseñarse y fabricarse de forma que se garanticen las características y prestaciones contempladas en la parte I, «Requisitos generales», con especial atención a:
la elección de los materiales utilizados, especialmente en lo que respecta a la toxicidad y, en su caso, la inflamabilidad;
la compatibilidad recíproca entre los materiales utilizados y los tejidos biológicos, células y líquidos corporales, teniendo en cuenta la finalidad prevista del producto;
si procede, los resultados de las investigaciones biofísicas, o bien de la modelización cuya validez se haya demostrado previamente.
7.2 Los productos deberán diseñarse, fabricarse y acondicionarse de forma que se minimice el riesgo presentado por los contaminantes y residuos para el personal que participe en el transporte, almacenamiento y utilización, así como para los pacientes, con arreglo a la finalidad prevista del producto. Deberá prestarse especial atención a los tejidos expuestos y a la duración y frecuencia de la exposición.
7.3 Los productos deberán diseñarse y fabricarse de modo que puedan utilizarse de forma totalmente segura con los materiales, sustancias y gases con los que entren en contacto durante su utilización normal o en procedimientos habituales; en caso de que los productos se destinen a la administración de medicamentos, deberán diseñarse y fabricarse de manera compatible con los medicamentos de que se trate con arreglo a las disposiciones y restricciones que rijan tales productos, y su utilización deberá ajustarse de modo permanente a la finalidad para la que estén destinados.
7.4 Cuando un producto incorpore, como parte integrante, una sustancia que, de utilizarse por separado, pueda considerarse un medicamento con arreglo a la definición del artículo 1 de la Directiva 2001/83/CE y que pueda ejercer en el cuerpo una acción accesoria a la del producto, la calidad, seguridad y utilidad de tal sustancia deberán verificarse por analogía con los métodos establecidos en la Directiva 2001/83/CE.
Para las sustancias a que se hace referencia en el párrafo primero, el organismo notificado, una vez verificada la utilidad de la sustancia como parte del producto sanitario y teniendo en cuenta la finalidad prevista del producto, deberá pedir a una de las autoridades competentes designadas por los Estados miembros o a la Agencia Europea de Medicamentos (EMEA), actuando en particular, mediante su comité con arreglo al Reglamento (CE) n.º 726/2004, un dictamen científico sobre la calidad y seguridad de dicha sustancia, incluida la relación beneficio clínico-riesgo de la incorporación de la sustancia en el producto. Cuando emitan su dictamen, la autoridad competente o la EMEA tendrán en cuenta el proceso de fabricación y los datos relativos a la utilidad de la incorporación de la sustancia en el producto, con arreglo a lo establecido por el organismo notificado.
Cuando el producto incorpore, como parte integrante, una sustancia derivada de la sangre humana, el organismo notificado, una vez verificada la utilidad de la sustancia como parte del producto sanitario y teniendo en cuenta la finalidad prevista del producto, deberá pedir a la EMEA, actuando en particular mediante su comité, un dictamen científico sobre la calidad y seguridad de la sustancia que se trate, incluida la relación beneficio clínico-riesgo de la incorporación de la sustancia derivada de la sangre humana en el producto. Cuando emita su dictamen, la EMEA tendrá en cuenta el proceso de fabricación y los datos relativos a la utilidad de la incorporación de la sustancia en el producto, con arreglo a lo establecido por el organismo notificado.
Cuando se modifique una sustancia accesoria incorporada en un producto, en particular con respecto a su proceso de fabricación, deberá informarse al organismo notificado de las modificaciones y este consultará a la autoridad competente en materia de medicamentos (es decir, la que haya participado en la consulta inicial), al objeto de confirmar el mantenimiento de la calidad y la seguridad de la sustancia accesoria. La autoridad competente tendrá en cuenta los datos relativos a la utilidad de la incorporación de la sustancia en el producto con arreglo a lo establecido por el organismo notificado para garantizar que los cambios no inciden negativamente en la relación beneficio-riesgo establecida respecto a la adición de la sustancia en el producto.
Cuando la autoridad competente en materia de medicamentos (es decir, la que haya participado en la consulta inicial) tenga información sobre la sustancia accesoria que pudiera incidir en la relación beneficio-riesgo establecida respecto a la adición de la sustancia en el producto sanitario, indicará al organismo notificado si esta información incide o no en la relación beneficio-riesgo establecida respecto a la adición de la sustancia en el producto sanitario. El organismo notificado tendrá en cuenta este dictamen científico actualizado a la hora de reexaminar su procedimiento de evaluación de conformidad.
7.5 Los productos deberán diseñarse y fabricarse de forma que se reduzcan al mínimo los riesgos que se deriven de las sustancias desprendidas por el producto. Se prestará una atención especial a las sustancias cancerígenas, mutágenas o tóxicas para la reproducción, de conformidad con lo establecido en el anexo VI del Reglamento (CE) n.º 1272/2008 del Parlamento Europeo y del Consejo, de 16 de diciembre de 2008, sobre clasificación, etiquetado y envasado de sustancias y mezclas, y por el que se modifican y derogan las Directivas 67/548/CEE y 1999/45/CE y se modifica el Reglamento (CE) n.º 1907/2006.
Si parte del producto (o el propio producto) destinado a administrar y/o retirar medicamentos, líquidos corporales u otras sustancias de o hacia el cuerpo, o si los productos destinados al transporte y al almacenamiento de estos líquidos o sustancias corporales contienen ftalatos que estén clasificados como cancerígenos, mutágenos o tóxicos para la reproducción, de las categorías 1 y 2, de conformidad con el anexo VI del Reglamento (CE) n.º 1272/2008 del Parlamento Europeo y del Consejo, de 16 de diciembre de 2008, estos productos deberán figurar en el etiquetado del propio producto y/o en el envase de cada unidad o, si procede, en los envases de venta como producto que contiene ftalato.
Si la finalidad prevista de estos productos incluye el tratamiento de niños o de mujeres embarazadas o lactantes, el fabricante deberá facilitar una justificación específica sobre el uso de estas sustancias en lo que se refiere al cumplimiento de los requisitos esenciales, en particular los recogidos en este párrafo, en la documentación técnica y, en las instrucciones de utilización, información sobre los riesgos residuales para estos grupos de pacientes y, si procede, sobre las medidas de precaución apropiadas.
7.6 Los productos deberán diseñarse y fabricarse de forma que se reduzcan lo más posible los riesgos que se deriven de la incorporación no intencionada de sustancias al producto, teniendo en cuenta el producto de que se trate y el tipo de entorno en que vaya a ser utilizado.
8. Infección y contaminación microbiana.
8.1 Los productos y sus procedimientos de fabricación deberán diseñarse de forma que se elimine o se reduzca lo más posible el riesgo de infección para el paciente, para el usuario y para terceros. El diseño deberá permitir una manipulación fácil y, siempre que esté indicado, minimizar la contaminación del producto por el paciente o viceversa durante la utilización.
8.2 Los tejidos de origen animal deberán proceder de animales que hayan sido sometidos a controles y seguimiento veterinario adecuados en función del uso al que se destinarán dichos tejidos.
Los organismos notificados conservarán los datos relativos a la procedencia geográfica de los animales.
Los tejidos, células y sustancias de origen animal se transformarán, conservarán, analizarán y manipularán de forma que ofrezcan las máximas garantías de seguridad. En concreto, para ofrecer garantías de que están libres de virus y otros agentes transmisibles, se utilizarán métodos reconocidos de eliminación o inactivación viral durante el proceso de fabricación.
8.3 Los productos suministrados en estado estéril deberán diseñarse, fabricarse y acondicionarse en un envase no reutilizable o según procedimientos apropiados de manera que sean estériles en el momento de su puesta en el mercado y que mantengan esta calidad en las condiciones previstas de almacenamiento y transporte hasta que el envase protector que garantice la esterilidad se deteriore o se abra.
8.4 Los productos suministrados en estado estéril deberán fabricarse y esterilizarse mediante un método adecuado y validado.
8.5 Los productos que deban ser esterilizados deberán fabricarse en condiciones adecuadamente controladas (por ejemplo, las relativas al medio ambiente).
8.6 Los sistemas de envasado destinados a los productos no estériles deberán ser tales que conserven el producto sin deterioro en el estado de limpieza previsto y, si el producto ha de esterilizarse antes de su utilización, deberán minimizar el riesgo de contaminación microbiana; el sistema de envasado deberá ser adecuado, en función del método de esterilización indicado por el fabricante.
8.7 El envase o el etiquetado del producto deberá permitir que se distingan los productos idénticos o similares vendidos a la vez en forma estéril y no estéril.
9. Propiedades relativas a la fabricación y al medio ambiente.
9.1 Cuando el producto se destine a utilizarse en combinación con otros productos o equipos, la combinación, comprendido el sistema de unión, deberá ser segura y no alterar las prestaciones previstas. Toda restricción de la utilización deberá figurar en la etiqueta o en las instrucciones de utilización.
9.2 Los productos deberán diseñarse y fabricarse de forma que se eliminen o se reduzcan lo más posible:
los riesgos de lesiones vinculados a sus características físicas, incluidas la relación volumen/presión, las características dimensionales y, en su caso, ergonómicas;
los riesgos vinculados a las condiciones del medio ambiente razonablemente previsibles, como los campos magnéticos, influencias eléctricas externas, descargas electrostáticas, presión, temperatura o variaciones de la presión o aceleración;
los riesgos de interferencia recíproca con otros productos, utilizados normalmente para las investigaciones o tratamientos efectuados;
los riesgos que se derivan, en caso de imposibilidad de mantenimiento o calibración (por ejemplo, en el caso de los productos implantables), del envejecimiento de los materiales utilizados o de la pérdida de precisión de un mecanismo de medida o de control.
9.3 Los productos deberán diseñarse y fabricarse de forma que en caso de que se utilicen normalmente y en condiciones de primer defecto, se minimicen los riesgos de incendio o de explosión. Habrá que prestar especial atención a los productos cuya finalidad prevista conlleve la exposición a sustancias inflamables o a sustancias capaces de favorecer la combustión.
10. Productos con función de medición.
10.1 Los productos con función de medición deberán diseñarse y fabricarse de forma que proporcionen una constancia y una precisión de la medición suficientes dentro de los límites de precisión adecuados a la finalidad del producto. Los límites de precisión serán indicados por el fabricante.
10.2 La escala de medida, de control y de visualización deberá diseñarse con arreglo a principios ergonómicos que tengan en cuenta la finalidad del producto.
10.3 Las mediciones efectuadas por los productos con función de medición deberán expresarse en unidades legales con arreglo a lo dispuesto en la Directiva 80/181/CEE del Consejo, de 20 de diciembre de 1979, relativa a la aproximación de las legislaciones de los Estados miembros sobre las unidades de medida.
11. Protección contra las radiaciones.
11.1 Requisitos generales.
11.1.1 Los productos deberán diseñarse y fabricarse de forma que se reduzca al mínimo compatible con el propósito perseguido cualquier exposición de los pacientes, usuarios y otras personas a las radiaciones, sin que por ello se limite la aplicación de los niveles adecuados que resulten indicados para los fines terapéuticos y diagnósticos.
11.2 Radiación deliberada.
11.2.1 Cuando los productos se diseñen para emitir niveles peligrosos de radiación necesarios para un propósito médico específico cuyo beneficio se considere superior a los riesgos inherentes a las emisiones, éstas tendrán que ser controlables por el usuario. Tales productos deberán diseñarse y fabricarse de forma que se asegure la reproducibilidad y la tolerancia de los parámetros variables pertinentes.
11.2.2 Cuando los productos estén destinados a emitir radiaciones potencialmente peligrosas, visibles y/o invisibles, deberán estar equipados, de ser posible, de indicadores visuales y/o sonoros que señalen la emisión de radiación.
11.3 Radiación no intencionada.
11.3.1 Los productos deberán diseñarse y fabricarse de forma que se reduzca al mínimo posible la exposición de pacientes, de usuarios y otras personas a emisiones de radiaciones no intencionadas, parásitas o dispersas.
11.4 Instrucciones de utilización.
11.4.1 Las instrucciones de utilización de los productos que emitan radiaciones deberán incluir información detallada sobre las características de la radiación emitida, los medios de protección del paciente y del usuario y las formas de evitar manipulaciones erróneas y de eliminar los riesgos derivados de la instalación.
11.5 Radiaciones ionizantes.
11.5.1 En la medida de lo posible, los productos que emitan radiaciones ionizantes deberán diseñarse y fabricarse de forma que se pueda regular y controlar la cantidad, la geometría y la calidad de las radiaciones emitidas en función del objetivo que se persigue.
11.5.2 Los productos que emitan radiaciones ionizantes para el diagnóstico radiológico deberán diseñarse y fabricarse para garantizar una buena calidad de imagen y/o de resultado acorde con la finalidad médica que se persiga, con una exposición mínima del paciente y del usuario a las radiaciones.
11.5.3 Los productos que emitan radiaciones ionizantes destinados a la radioterapia deberán diseñarse y fabricarse de forma tal que permitan una vigilancia y un control fiables de las dosis administradas, del tipo de haz, de la energía y, en su caso, del tipo de radiación.
12. Requisitos para los productos sanitarios conectados a una fuente de energía o equipados con una fuente de energía.
12.1 Los productos que lleven incorporados sistemas electrónicos programables deberán diseñarse de forma que se garanticen la repetibilidad, fiabilidad y eficacia de dichos sistemas, en consonancia con la utilización a que estén destinados. En caso de condiciones de primer defecto en el sistema, deberán preverse los medios para poder eliminar o reducir lo más posible los riesgos consiguientes.
12.1 bis Para los productos que incorporen programas informáticos o que sean programas informáticos médicos, dichos programas informáticos deben ser validados con arreglo al estado actual de la técnica, teniendo en cuenta los principios de desarrollo del ciclo de vida, gestión de los riesgos, validación y verificación.
12.2 Los productos que posean una fuente de energía interna de la que dependa la seguridad de los pacientes deberán estar provistos de un medio que permita determinar el estado de la fuente de energía.
12.3 Los productos conectados a una fuente de energía externa de la que dependa la seguridad de los pacientes deberán incluir un sistema de alarma que señale cualquier fallo de la fuente de energía.
12.4 Los productos destinados a vigilar uno o varios parámetros clínicos de un paciente deberán estar provistos de sistemas de alarma adecuados que permitan avisar al usuario de las situaciones que pudieran provocar la muerte o un deterioro grave del estado de salud del paciente.
12.5 Los productos deberán diseñarse y fabricarse de forma que se minimicen los riesgos de creación de campos electromagnéticos que pudieran afectar al funcionamiento de otros productos o equipos situados en su entorno habitual.
12.6 Protección contra los riesgos eléctricos.–Los productos deberán diseñarse y fabricarse de forma que, cuando estén correctamente instalados y se utilicen normalmente o en condiciones de primer defecto, se eviten en la medida de lo posible los riesgos de choque eléctrico accidental.
12.7 Protección contra los riesgos mecánicos y térmicos.
12.7.1 Los productos deberán diseñarse y fabricarse de forma que el paciente y el usuario estén protegidos de los riesgos mecánicos relacionados, por ejemplo, con la resistencia, la estabilidad y las piezas móviles.
12.7.2 Los productos deberán diseñarse y fabricarse de forma que los riesgos derivados de las vibraciones producidas por los productos se reduzcan al mínimo nivel posible, teniendo en cuenta el progreso técnico y la disponibilidad de medios de reducción de las vibraciones, especialmente en su origen, salvo si las vibraciones forman parte de las prestaciones previstas.
12.7.3 Los productos deberán diseñarse y fabricarse de forma que los riesgos derivados de la emisión de ruido se reduzcan al mínimo posible, teniendo en cuenta el progreso técnico y la disponibilidad de medios de reducción del ruido, especialmente en su origen, salvo si las emisiones sonoras forman parte de las prestaciones previstas.
12.7.4 Los terminales y los dispositivos de conexión a fuentes de energía eléctrica, hidráulica, neumática o gaseosa que tengan que ser manipulados por el usuario deberán diseñarse y fabricarse de forma que se reduzca al mínimo cualquier posible riesgo.
12.7.5 Las partes accesibles de los productos (con exclusión de las partes o de las zonas destinadas a proporcionar calor o a alcanzar determinadas temperaturas) y su entorno no deberán alcanzar temperaturas que puedan representar un peligro en condiciones de utilización normal.
12.8 Protección contra los riesgos que puedan presentar para el paciente las fuentes de energía o la administración de sustancias.
12.8.1 El diseño y la construcción de los productos destinados a proporcionar energía o sustancias al paciente deberán ser tales que el aporte pueda regularse y mantenerse con precisión suficiente para garantizar la seguridad del paciente y del usuario.
12.8.2 El producto deberá estar provisto de medios que permitan impedir y/o señalar cualquier incorrección del ritmo de aporte del producto cuando de ella pueda derivarse algún peligro.–Los productos deberán estar dotados de medios adecuados para impedir, dentro de lo que cabe, la liberación accidental de cantidades peligrosas de energía procedente de una fuente de energía y/o de sustancias.
12.9 La función de los mandos e indicadores deberá estar indicada claramente en los productos.–En caso de que un producto vaya acompañado de instrucciones necesarias para su utilización o indicaciones de mando o regulación mediante un sistema visual, dicha información deberá ser comprensible para el usuario y, si procede, para el paciente.
13. Datos proporcionados por el fabricante.
13.1 Cada producto deberá ir acompañado de la información necesaria para su utilización con plena seguridad y adecuadamente, teniendo en cuenta la formación y los conocimientos de los usuarios potenciales, y para identificar al fabricante.
Esta información estará constituida por las indicaciones que figuren en la etiqueta y las que figuren en las instrucciones de utilización.
Los datos necesarios para la utilización del producto con plena seguridad deberán figurar, siempre que sea factible y adecuado, en el propio producto y/o en un envase unitario o, en su caso, en el envase comercial. Si no es factible envasar individualmente cada unidad, estos datos deberán figurar en unas instrucciones de utilización que acompañen a uno o varios productos.
Todos los productos deberán incluir en su envase las instrucciones de utilización. Excepcionalmente, estas instrucciones no serán necesarias en el caso de los productos de las clases I y IIa, si la completa seguridad de su utilización puede garantizarse sin ayuda de tales instrucciones.
13.2 Los datos podrán adoptar, cuando sea apropiado, la forma de símbolos. Los símbolos y los colores de identificación que se utilicen deberán ajustarse a las normas armonizadas. Si no existe ninguna norma en este campo, los símbolos y colores se describirán en la documentación que acompañe al producto.
13.3 La etiqueta deberá incluir los siguientes datos:
a) El nombre o la razón social y la dirección del fabricante. Por lo que respecta a los productos importados en el territorio comunitario con vistas a su distribución en el mismo, la etiqueta, el envase exterior o las instrucciones de utilización deberán incluir, además, el nombre y la dirección del representante autorizado, cuando el fabricante carezca de domicilio social en la Comunidad.
b) La información estrictamente necesaria para identificar el producto y el contenido del envase, en particular por parte de los usuarios.
c) Cuando sea apropiado, la palabra «estéril».
d) El código del lote precedido por la palabra «lote» o el número de serie, según proceda.
e) Cuando sea apropiado, la fecha antes de la cual deberá utilizarse el producto para tener plena seguridad, expresada en año y mes.
f) La indicación, cuando sea apropiado, de que el producto es de un solo uso. La indicación del fabricante de que el producto es de un solo uso debe ser homogénea en toda la Comunidad.
g) En el caso de los productos a medida, la indicación «producto a medida».
h) Si se trata de un producto destinado a investigaciones clínicas, la indicación «exclusivamente para investigaciones clínicas».
i) Las condiciones específicas de almacenamiento y/o conservación.
j) Las instrucciones especiales de utilización.
k) Cualquier advertencia y/o precaución que deba adoptarse.
l) El año de fabricación para los productos activos no contemplados en la anterior letra e). Esta indicación podrá incluirse en el número de lote o de serie.
m) Cuando sea apropiado, el método de esterilización.
n) Cuando se trate de uno de los productos que se citan en el apartado 5 del artículo 3, una indicación de que el producto contiene como parte integrante una sustancia derivada de la sangre humana.
13.4 Si la finalidad prevista de un producto no es evidente para el usuario, el fabricante deberá indicarla claramente en la etiqueta y en las instrucciones de utilización.
13.5 Los productos y sus componentes separables deberán identificarse, en su caso, en términos de lotes, si ello es razonablemente factible, con el fin de posibilitar cualquier medida adecuada para la detección de un posible riesgo relativo a los productos y sus componentes separables.
13.6 Las instrucciones de utilización deberán incluir, según proceda, los datos siguientes:
a) Las indicaciones contempladas en el párrafo 13.3, salvo las que figuran en las letras d) y e).
b) Las prestaciones contempladas en el apartado 3 y los posibles efectos secundarios no deseados.
c) Cuando un producto deba instalarse con otros productos o equipos sanitarios, o conectarse a los mismos para funcionar con arreglo a su finalidad prevista, deberá incluirse información suficiente sobre sus características para identificar los productos o equipos correctos que deberán utilizarse a fin de tener una combinación segura.
d) Todos los datos que permitan comprobar si el producto está bien instalado y puede funcionar correctamente y con plena seguridad, así como los datos relativos a la naturaleza y a la frecuencia de las operaciones de mantenimiento y calibrado que haya que efectuar para garantizar permanentemente el buen funcionamiento y la seguridad de los productos.
e) La información útil para evitar, en su caso, ciertos riesgos relacionados con la implantación del producto.
f) La información relativa a los riesgos de interferencia recíproca relacionados con la presencia del producto en investigaciones o tratamientos específicos.
g) Las instrucciones necesarias en caso de rotura del envase protector de la esterilidad y, en su caso indicación de los métodos adecuados de reesterilización.
h) Si un producto está destinado a reutilizarse, los datos sobre los procedimientos apropiados para la reutilización, incluida la limpieza, la desinfección, el acondicionamiento y, en su caso, el método de esterilización si el producto debe ser reesterilizado, así como cualquier limitación respecto al número posible de reutilizaciones.
En caso de que los productos deban ser esterilizados antes de su uso, las instrucciones de limpieza y esterilización deberán estar formuladas de modo que si se siguen correctamente, el producto siga cumpliendo los requisitos de la parte I.
Si el producto contiene la indicación de que el producto es de un solo uso, la información sobre las características conocidas y los factores técnicos conocidos por el fabricante que pudieran suponer un riesgo si el producto se utilizase de nuevo. Si, de conformidad con el punto 13.1, no son necesarias instrucciones de utilización, la información deberá facilitarse al usuario, previa solicitud.
i) Información sobre cualquier tratamiento o manipulación adicional que deba realizarse antes de utilizar el producto (por ejemplo, esterilización, montaje final, etcétera).
j) Cuando un producto emita radiaciones con fines médicos, la información relativa a la naturaleza, tipo, intensidad y distribución de dicha radiación.
Las instrucciones de utilización deberán incluir además información que permita al personal médico informar al paciente sobre las contraindicaciones y las precauciones que deben tomarse. Esta información hará referencia particularmente a:
k) Las precauciones que deban adoptarse en caso de cambios del funcionamiento del producto.
l) Las precauciones que deban adoptarse en lo que respecta a la exposición, en condiciones ambientales razonablemente previsibles, a campos magnéticos, a influencias eléctricas externas, a descargas electrostáticas, a la presión o variaciones de presión, a la aceleración, a fuentes térmicas de ignición, etcétera.
m) Información suficiente sobre el medicamento o los medicamentos que el producto de que se trate esté destinado a administrar, incluida cualquier restricción en la elección de sustancias que se puedan suministrar.
n) Las precauciones que deban adoptarse si un producto presenta un riesgo inhabitual específico asociado a su eliminación.
o) Los medicamentos o las sustancias derivadas de la sangre humana incluidos en el producto como parte integrante del mismo conforme al apartado 7.4.
p) El grado de precisión atribuido a los productos de medición.
q) Fecha de publicación de la última revisión de las instrucciones de uso.
(Sistema completo de garantía de calidad)
1. El fabricante se cerciorará de que se aplica el sistema de calidad aprobado para el diseño, la fabricación y el control final de los productos sanitarios de que se trate, tal como se estipula en el apartado 3, y quedará sujeto a la auditoría a que se refieren los apartados 3.3 y 4 y al control CE, tal como se establece en el apartado 5.
2. La declaración de conformidad CE es el procedimiento mediante el cual el fabricante que cumple las obligaciones impuestas por el punto 1 asegura y declara que los productos en cuestión cumplen las disposiciones de este real decreto que les son aplicables.
El fabricante colocará el marcado CE con arreglo a lo establecido en el artículo 12 y efectuará una declaración escrita de conformidad. La declaración se referirá a uno o varios productos sanitarios fabricados, claramente identificados mediante el nombre del producto, el código del producto u otra referencia inequívoca, y deberá ser conservada por el fabricante.
3. Sistema de calidad.
3.1 El fabricante presentará ante un organismo notificado una solicitud de evaluación de su sistema de calidad.
Dicha solicitud deberá contener:
El nombre y apellidos y la dirección del fabricante y cualesquiera otros locales de fabricación incluidos en el sistema de calidad.
Toda la información pertinente sobre los productos o la categoría de productos objeto del procedimiento.
Una declaración escrita que especifique que no se ha presentado ante otro organismo notificado ninguna solicitud paralela relativa al mismo sistema de calidad vinculado al producto.
La documentación relativa al sistema de calidad.
Un compromiso por parte del fabricante de cumplir las obligaciones derivadas del sistema de calidad aprobado.
Un compromiso por parte del fabricante de velar porque el sistema de calidad aprobado mantenga su adecuación y eficacia.
Un compromiso, por parte del fabricante, de establecer y mantener actualizado un procedimiento sistemático para revisar la experiencia adquirida con los productos en la fase posterior a la producción, incluidas las disposiciones a que se refiere el anexo X, y para emplear los medios adecuados para aplicar las medidas correctoras que resulten necesarias. El compromiso incluirá la obligación, por parte del fabricante, de informar a las autoridades competentes sobre los siguientes hechos tan pronto como tenga conocimiento de los mismos:
i. cualquier funcionamiento defectuoso o alteración de las características o de las prestaciones, así como cualquier inadecuación del etiquetado o de las instrucciones de utilización de un producto que pueda dar lugar o haya podido dar lugar a la muerte o a la alteración grave del estado de salud de un paciente o de un usuario;
ii. cualquier razón de carácter técnico o sanitario ligada a las características o las prestaciones de un producto que por las razones indicadas en el anterior inciso i haya inducido al fabricante a realizar una acción sistemática sobre productos del mismo tipo.
3.2 La aplicación del sistema de calidad deberá garantizar la conformidad de los productos con las disposiciones aplicables de este real decreto en todas las fases, desde el diseño hasta los controles finales. Todos los elementos, requisitos y disposiciones adoptados por el fabricante para su sistema de calidad deberán consignarse en una documentación sistemática y ordenada en forma de políticas y procedimientos escritos. Esta documentación sobre el sistema de calidad deberá permitir una interpretación uniforme de las condiciones y procedimientos en materia de calidad, como programas, planes, manuales y registros relativos a la calidad.
Incluirá, en particular, los documentos, datos y registros derivados de los procedimientos contemplados en la letra c).
En particular, deberá contener una descripción adecuada de:
a) Los objetivos de calidad del fabricante.
b) La organización de la empresa, en particular:
Las estructuras de organización, las responsabilidades de los directivos y su autoridad organizativa en materia de calidad del diseño y de la fabricación de los productos.
Los métodos para controlar el funcionamiento eficaz del sistema de calidad y, en particular, su aptitud para dar lugar al nivel deseado de calidad del diseño y de los productos, incluido el control de los productos no conformes.
Los métodos de control de la eficacia del funcionamiento del sistema de calidad, en particular del tipo y el alcance del control aplicado al tercero en cuestión, en caso de que sea un tercero quien realice el diseño, fabrique y/o lleve a cabo la inspección final y el ensayo de los productos o de sus componentes.
c) Los procedimientos de control y verificación del diseño de los productos, incluida la documentación correspondiente, y, en particular:
Una descripción general del producto, incluidas las variantes previstas y de su finalidad o finalidades previstas.
Las especificaciones de diseño, incluidas las normas aplicables y los resultados del análisis de riesgos, así como la descripción de las soluciones adoptadas para que se respeten los requisitos esenciales aplicables a los productos cuando las normas contempladas en el artículo 6 no se apliquen en su totalidad.
Las técnicas de control y de verificación del diseño, los procedimientos y las medidas sistemáticas que se hayan de aplicar en la fase de diseño de los productos.
Cuando el producto haya de conectarse a otro u otros productos para poder funcionar con arreglo a su finalidad prevista, la prueba de que el producto se ajusta a los requisitos esenciales una vez conectado con cualquiera de esos productos que posea las características especificadas por el fabricante.
Una declaración que indique si el producto contiene, como parte integrante, una sustancia o un derivado de sangre humana de los contemplados en el apartado 7.4 del anexo I, así como los datos relativos a las pruebas realizadas al respecto y que son necesarios para evaluar la seguridad, calidad y utilidad de la sustancia o del derivado de sangre humana, teniendo en cuenta la finalidad prevista del producto.
Una declaración que indique si se han utilizado o no en la fabricación del producto tejidos de origen animal de conformidad con el anexo XIII de este real decreto.
Las soluciones adoptadas con arreglo al anexo I, título I, punto 2.
La evaluación preclínica.
La evaluación clínica contemplada en el anexo X.
El modelo de etiqueta y, en su caso, de instrucciones de utilización.
d) Las técnicas de control y de garantía de calidad en la fabricación y, en particular:
los procesos y procedimientos, que se vayan a utilizar, en particular en materia de esterilización y de compra, y los documentos pertinentes,
los procedimientos de identificación del producto adoptados y actualizados, a partir de dibujos, especificaciones u otros documentos pertinentes, a lo largo de todas las fases de fabricación.
e) Los estudios y ensayos adecuados que se efectuarán antes, durante y después de la producción, la frecuencia con que se llevarán a cabo y los equipos de ensayo que se utilizarán; deberá poder comprobarse adecuadamente el calibrado de los equipos de ensayo.
3.3 El organismo notificado realizará una auditoría del sistema de calidad para determinar si reúne los requisitos contemplados en el apartado 3.2. Dará por supuesta la conformidad con dichos requisitos si los sistemas de calidad cumplen las normas armonizadas correspondientes.
Al menos uno de los miembros del equipo encargado de la evaluación deberá tener experiencia en evaluaciones dentro del ámbito tecnológico de que se trate. El procedimiento de evaluación deberá incluir una evaluación representativa de la documentación relativa al diseño del producto o productos de que se trate, una inspección de las instalaciones del fabricante, y en casos justificados, de las instalaciones de los proveedores y/o subcontratistas del fabricante, para inspeccionar los procedimientos de fabricación.
Se notificará al fabricante la decisión y en ella figurarán las conclusiones de la inspección y una evaluación motivada.
3.4 El fabricante informará al organismo notificado que haya aprobado el sistema de calidad de cualquier proyecto de modificación importante de dicho sistema de calidad o de la gama de productos incluidos. El organismo notificado evaluará las modificaciones propuestas y comprobará si el sistema de calidad así modificado sigue respondiendo a los requisitos mencionados en el apartado 3.2, notificará su decisión al fabricante. Dicha decisión incluirá las conclusiones de la inspección y una evaluación motivada.
4. Examen del diseño del producto.
4.1 El fabricante, además de las obligaciones que le conciernen con arreglo al apartado 3, presentará al organismo notificado una solicitud de examen del expediente de diseño relativo al producto que vaya a fabricar y que forme parte de la categoría mencionada en el apartado 3.1.
4.2 La solicitud describirá el diseño, la fabricación y las prestaciones del producto sanitario de que se trate e incluirá los documentos necesarios, contemplados en el párrafo c) del apartado 3.2, que permitan juzgar su conformidad con los requisitos de este real decreto.
4.3 El organismo notificado examinará la solicitud y, si el producto cumple los requisitos de este real decreto que sean de aplicación, expedirá un certificado de examen CE del diseño al solicitante. El organismo notificado podrá exigir que la solicitud se complete con ensayos o pruebas adicionales, a fin de que pueda evaluarse la conformidad con los requisitos de la presente disposición. En el certificado constarán las conclusiones del examen, las condiciones de su validez, los datos necesarios para la identificación del diseño aprobado y, en su caso, una descripción de la finalidad del producto.
Cuando se trate de los productos contemplados en el anexo I punto 7.4, párrafo segundo, el organismo notificado consultará, en lo referente a los aspectos contemplados en dicho punto, a una de las autoridades competentes designadas por los Estados miembros de conformidad con la Directiva 2001/83/CE o a la EMEA antes de tomar una decisión. El dictamen de la autoridad nacional competente o de la EMEA se elaborará dentro de los 210 días siguientes a la recepción de la documentación válida. En la documentación del producto se incluirá el dictamen científico de la autoridad nacional competente o de la EMEA. Al adoptar su decisión, el organismo notificado tomará debidamente en cuenta los dictámenes emitidos respecto a su consulta e informará de su decisión final al organismo competente que corresponda.
Cuando se trate de productos contemplados en el anexo I, punto 7.4, párrafo tercero, deberá incluirse en la documentación del producto el dictamen científico de la EMEA. Este dictamen se elaborará dentro de los 210 días siguientes a la recepción de la documentación válida. Al adoptar su decisión, el organismo notificado tomará debidamente en cuenta dicho dictamen. El organismo notificado, no podrá expedir el certificado si el dictamen de la EMEA fuere desfavorable. Comunicará a la EMEA su decisión final.
Cuando se trate de productos en cuya fabricación se utilicen tejidos de origen animal, el organismo notificado deberá seguir los procedimientos previstos en el artículo 20 de este real decreto.
4.4 Las modificaciones introducidas en el diseño aprobado deberán recibir una aprobación complementaria del organismo notificado que haya expedido el certificado de examen CE del diseño, cuando tales modificaciones puedan afectar a la conformidad con los requisitos esenciales de la presente disposición o con las condiciones estipuladas para la utilización del producto. El solicitante informará al organismo notificado que haya expedido el certificado de examen CE del diseño sobre cualquier modificación que se haya introducido en el diseño aprobado. La aprobación complementaria será concedida en forma de apéndice del certificado de examen CE del diseño.
5. Control.
5.1 El objeto del control es garantizar el correcto cumplimiento por parte del fabricante, de las obligaciones que se derivan del sistema de calidad aprobado.
5.2 El fabricante deberá autorizar al organismo notificado a efectuar todas las inspecciones necesarias y le facilitará toda la información pertinente, en particular:
La documentación relativa al sistema de calidad.
Los datos previstos en la parte del sistema de calidad relativa al diseño, por ejemplo los resultados de los análisis, los cálculos, los ensayos, las soluciones adoptadas con arreglo al anexo I, título I, punto 2, la evaluación preclínica y clínica, el plan de seguimiento clínico post-comercialización, los resultados de este seguimiento, si procede, etc.
Los datos previstos en la parte del sistema de calidad relativa a la fabricación, tales como los informes correspondientes a las inspecciones, los ensayos, las calibraciones, la cualificación del personal correspondiente, etc.
5.3 El organismo notificado realizará periódicamente las inspecciones y evaluaciones adecuadas a fin de cerciorarse de que el fabricante aplica el sistema de calidad aprobado, y facilitará un informe de evaluación al fabricante.
5.4 El organismo notificado podrá asimismo visitar sin previo aviso al fabricante. Con ocasión de estas visitas, el organismo notificado podrá efectuar o hacer que se efectúen ensayos para verificar el buen funcionamiento del sistema de calidad, en caso de considerarlo necesario, y entregará al fabricante un informe de inspección y, si se ha realizado algún ensayo, un informe de ensayo.
6. Disposiciones administrativas.
6.1 El fabricante o su representante autorizado deberá tener a disposición de las autoridades nacionales por un período de tiempo no inferior a cinco años y, en el caso de los productos implantables, de al menos quince años después de que haya sido fabricado el último producto:
la declaración de conformidad,
la documentación contemplada en el cuarto guión del apartado 3.1, y, en particular, los documentos, los datos y los registros contemplados en el punto 3.2, párrafo segundo.
las modificaciones contempladas en el apartado 3.4,
la documentación contemplada en el apartado 4.2, y
las decisiones e informes del organismo notificado contemplados en los apartados 3.3, 4.3, 4.4, 5.3 y 5.4.
7. Aplicación a los productos de las clases IIa y IIb.
7.1 El presente anexo podrá aplicarse, con arreglo a los apartados 1.b) y 1.c) del artículo 13, a los productos de las clases IIb y IIa. No obstante, no se aplicará lo dispuesto en el apartado 4.
7.2 Para los productos de la clase IIa, el organismo notificado evaluará, como parte de la evaluación contemplada en el punto 3.3, la documentación técnica descrita en el punto 3.2, letra c), al menos respecto de una muestra representativa de cada subcategoría de productos, por lo que se refiere al cumplimiento de las disposiciones de este real decreto.
7.3 Para los productos de la clase IIb, el organismo notificado evaluará, como parte de la evaluación contemplada en el punto 3.3, la documentación técnica descrita en el punto 3.2, letra c), al menos respecto de una muestra representativa de cada grupo genérico, por lo que se refiere al cumplimiento de las disposiciones de este real decreto.
7.4 Para escoger la(s) muestra(s) representativa(s), el organismo notificado tendrá en cuenta la novedad de la tecnología, las similitudes de diseño, la tecnología, los métodos de fabricación y esterilización, la finalidad prevista y los resultados de las evaluaciones anteriores pertinentes (por ejemplo, de propiedades físicas, químicas o biológicas) efectuadas conforme a este real decreto. El organismo notificado documentará y pondrá a disposición de la autoridad competente los fundamentos en que se basa para recoger la(s) muestra(s).
7.5 El organismo notificado evaluará otras muestras como parte de la evaluación de control contemplada en el punto 5.
8. Aplicación a los productos contemplados en el apartado 5 del artículo 3.–Al término de la fabricación de cada lote de productos contemplados en el apartado 5 del artículo 3, el fabricante informará al organismo notificado de la liberación de este lote de productos y remitirá el certificado oficial de liberación del lote de sustancias derivadas de la sangre humana utilizado en dicho producto, expedido por un laboratorio estatal o un laboratorio designado a tal fin por un Estado miembro, con arreglo al artículo 114, apartado 2, de la Directiva 2001/83CE.
1. El examen CE de tipo es el procedimiento mediante el cual un organismo notificado comprueba y certifica que una muestra representativa de la producción considerada cumple las disposiciones de este real decreto.
2. La solicitud deberá incluir:
el nombre y dirección del fabricante, así como el nombre y dirección de su representante autorizado en caso de que sea éste quien presente la solicitud;
la documentación contemplada en el apartado 3, necesaria para poder evaluar la conformidad de la muestra representativa de la producción considerada, en lo sucesivo denominada «tipo», con los requisitos de la presente disposición. El solicitante pondrá a disposición del organismo notificado un «tipo». El organismo notificado podrá solicitar otros ejemplares si fuese necesario;
una declaración escrita en la que se especifique que no se ha presentado ante otro organismo notificado ninguna solicitud referente al mismo tipo.
3. La documentación deberá permitir la comprensión del diseño, fabricación y prestaciones del producto. Deberá incluir, en particular, los siguientes elementos:
Una descripción general del tipo, incluidas las variantes previstas, y de su finalidad o finalidades previstas.
Los dibujos de diseño, métodos de fabricación previstos, en particular en materia de esterilización, esquemas de componentes, subconjuntos, circuitos, etcétera.
Las descripciones y explicaciones necesarias para la comprensión de los dibujos y esquemas mencionados y del funcionamiento del producto.
Una lista de las normas contempladas en el artículo 6, aplicadas total o parcialmente, así como la descripción de las soluciones adoptadas para cumplir los requisitos esenciales cuando no se apliquen totalmente las normas contempladas en el artículo 6.
Los resultados de los cálculos de diseño, análisis de riesgos, investigaciones, ensayos técnicos, etc., que se hayan realizado.
Una declaración que indique si el producto contiene, como parte integrante, una sustancia o un derivado de sangre humana con arreglo a lo indicado en el apartado 7.4 del anexo I, así como los datos relativos a las pruebas realizadas al respecto y que son necesarias para evaluar la seguridad, calidad y utilidad de la sustancia o del derivado de sangre humana de que se trate, teniendo en cuenta la finalidad prevista del producto.
Una declaración que indique si se han utilizado o no en la fabricación del producto tejidos de origen animal de conformidad con la Directiva 2003/32/CE.
La soluciones adoptadas con arreglo al anexo I, título I, punto 2.
La evaluación preclínica.
La evaluación clínica contemplada en el anexo X.
El proyecto de etiquetas y, en su caso, de instrucciones de utilización.
4. El organismo notificado.
4.1 Examinará y evaluará la documentación y comprobará que el tipo se ha fabricado de acuerdo con la misma; señalará asimismo los elementos que se hayan diseñado de conformidad con las disposiciones aplicables de las normas contempladas en el artículo 6, así como los elementos cuyo diseño no se base en las correspondientes disposiciones de dichas normas.
4.2 Efectuará o hará efectuar los adecuados controles y los ensayos necesarios para comprobar si las soluciones adoptadas por el fabricante cumplen los requisitos esenciales de la presente disposición, cuando no se apliquen las normas contempladas en el artículo 6; cuando un producto haya de conectarse a otro producto o productos para poder funcionar con arreglo a su finalidad prevista, deberá probarse que el primer producto cumple los requisitos esenciales al estar conectado a los productos que poseen las características indicadas por el fabricante.
4.3 Efectuará o hará efectuar los adecuados controles y los ensayos necesarios para comprobar si, en caso de que el fabricante haya decidido aplicar las normas pertinentes, éstas se han aplicado realmente.
4.4 Acordará con el solicitante el lugar en que vayan a efectuarse los controles y los ensayos necesarios.
5. Cuando el tipo cumpla las disposiciones de este real decreto, el organismo notificado expedirá al solicitante un certificado de examen CE de tipo. El certificado contendrá el nombre y la dirección del fabricante, las conclusiones de la inspección, las condiciones de validez del certificado y los datos necesarios para la identificación del tipo aprobado. Se adjuntarán al certificado las partes pertinentes de la documentación; el organismo notificado conservará una copia.
Cuando se trate de los productos contemplados en el anexo I, punto 7.4, párrafo segundo, el organismo notificado consultará, en lo referente a los aspectos contemplados en dicho punto, a una de las autoridades competentes designadas por los Estados miembros de conformidad con la Directiva 2001/83/CE o a la EMEA antes de tomar una decisión. El dictamen de la autoridad nacional competente o de la EMEA se elaborará dentro de los 210 días siguientes a la recepción de la documentación válida. En la documentación del producto se incluirá el dictamen científico de la autoridad nacional competente o de la EMEA. El organismo notificado tendrá debidamente en cuenta las opiniones manifestadas en la consulta al adoptar su decisión. Comunicará su decisión final al organismo competente de que se trate.
Cuando se trate de productos contemplados en el anexo I, punto 7.4, párrafo tercero, deberá incluirse en la documentación del producto el dictamen científico de la EMEA. El dictamen de la EMEA se elaborará dentro de los 210 días siguientes a la recepción de la documentación válida. Al adoptar su decisión, el organismo notificado tomará debidamente en cuenta dicho dictamen. El organismo notificado no podrá expedir el certificado si el dictamen de la EMEA fuere desfavorable. Comunicará a la EMEA su decisión final.
Cuando se trate de productos en cuya fabricación se utilicen productos de origen animal. El organismo notificado deberá seguir los procedimientos previstos en el artículo 20 de este real decreto.
6. El solicitante informará al organismo notificado que haya expedido el certificado de examen CE de tipo sobre cualquier modificación importante que se introduzca en el producto aprobado.
Cuando las modificaciones introducidas en el tipo aprobado puedan afectar a su conformidad con los requisitos esenciales o con las condiciones de utilización previstas del producto, el organismo notificado que haya expedido el certificado de examen CE de tipo deberá aprobar asimismo dichas modificaciones. Esta aprobación complementaria se expedirá, en su caso, en forma de apéndice del certificado inicial de examen CE de tipo.
7. Disposiciones administrativas.
7.1 Los demás organismos notificados podrán obtener una copia de los certificados de examen CE de tipo y de sus apéndices. Los apéndices de los certificados estarán a disposición de los demás organismos notificados que presenten una solicitud motivada, previa información al fabricante.
7.2 El fabricante o su representante autorizado deberá conservar una copia de los certificados de examen CE de tipo y de sus complementos junto con la documentación técnica durante un plazo de por lo menos cinco años a partir de la fecha de fabricación del último producto. En el caso de los productos implantables, el período deberá ser de al menos quince años después de que haya sido fabricado el último producto.
1. La verificación CE es el procedimiento por el que el fabricante o su representante autorizado asegura y declara que los productos sometidos a lo dispuesto en el apartado 4 son conformes al tipo descrito en el certificado de examen CE de tipo y cumplen los requisitos de este real decreto que le son aplicables.
2. El fabricante tomará las medidas necesarias para que el procedimiento de fabricación garantice la conformidad de los productos con el tipo descrito en el certificado de examen CE de tipo y con los requisitos de este real decreto que les sean aplicables. Antes de empezar la fabricación, deberá elaborar una documentación en la que se definan los procedimientos de fabricación, en particular, cuando corresponda, en lo relativo a la esterilización, así como el conjunto de disposiciones preestablecidas y sistemáticas que se vayan a aplicar para garantizar la homogeneidad de la producción y, en su caso, la conformidad de los productos con el tipo descrito en el certificado de examen CE de tipo y con los requisitos de este real decreto que les sean aplicables. Aplicará el marcado CE con arreglo al artículo 12 y realizará una declaración de conformidad.
Además, cuando se trate de productos puestos en el mercado en condiciones de esterilidad, y únicamente para los aspectos de la fabricación destinados a la obtención de la condición de esterilidad y a su mantenimiento, el fabricante aplicará las disposiciones de los puntos 3 y 4 del anexo V.
3. El fabricante se comprometerá a establecer y mantener actualizado un procedimiento sistemático para revisar la experiencia adquirida con los productos en la fase posterior a la producción, incluidas las disposiciones a que se refiere el anexo X y para emplear los medios apropiados para aplicar las medidas correctoras que resulten necesarias. El compromiso incluirá la obligación, por parte del fabricante, de informar a las autoridades competentes sobre los siguientes hechos tan pronto como tenga conocimiento de los mismos:
i. Cualquier funcionamiento defectuoso o alteración de las características o de las prestaciones, así como cualquier inadecuación del etiquetado o de las instrucciones de utilización de un producto que pueda dar lugar o haya podido dar lugar a la muerte o la alteración grave del estado de salud de un paciente o de un usuario.
ii. Cualquier razón de carácter técnico o sanitario ligada a las características o las prestaciones de un producto por las razones indicadas en el anterior inciso i que haya inducido al fabricante a realizar una acción sistemática sobre productos del mismo tipo.
4. El organismo notificado efectuará los exámenes y ensayos apropiados a fin de verificar la conformidad del producto con los requisitos de este real decreto, bien mediante control y ensayo de cada producto según se especifica en el punto 5 o bien mediante control y ensayo de los productos de forma estadística según se especifica en el punto 6, a elección del fabricante.
Las verificaciones mencionadas anteriormente no se aplicarán en lo que se refiere a los aspectos de fabricación que tengan relación con la obtención de la esterilidad.
5. Verificación mediante control y ensayo de cada producto.
5.1 Todos los productos se examinarán individualmente y se efectuarán los ensayos adecuados, definidos en la norma o normas aplicables contempladas en el artículo 6 o ensayos equivalentes, con el fin de verificar su conformidad, cuando corresponda, con el tipo descrito en el certificado de examen CE de tipo y con los requisitos de este real decreto que les son aplicables.
5.2 El organismo notificado pondrá o hará poner su número de identificación en cada producto aprobado y expedirá un certificado escrito de conformidad correspondiente a los ensayos efectuados.
6. Verificación estadística.
6.1 El fabricante presentará los productos fabricados en forma de lotes homogéneos.
6.2 Se tomará una muestra al azar de cada lote. Los productos que constituyan la muestra se examinarán individualmente y, para verificar su conformidad, cuando corresponda, con el tipo descrito en el certificado de examen CE de tipo y con los requisitos aplicables del real decreto, se efectuarán los ensayos pertinentes definidos en la norma o normas aplicables contempladas en el artículo 6, o bien ensayos equivalentes, con objeto de determinar la aceptación o el rechazo del lote.
6.3 El control estadístico de los productos se realizará por propiedades y/o variables, lo que supondrá sistemas de muestreo con características operativas que garanticen un alto nivel de seguridad y de prestaciones conforme al estado actual de la técnica. Los sistemas de muestreo se determinarán con arreglo a las normas armonizadas contempladas en el artículo 6, teniendo en cuenta la especificidad de las categorías de productos de que se trate.
6.4 Si un lote es aceptado, el organismo notificado pondrá o hará poner su número de identificación en cada producto y extenderá un certificado escrito de conformidad correspondiente a los ensayos efectuados. Todos los productos del lote podrán ponerse en el mercado, excepto los productos de la muestra que no sean conformes.
Si un lote es rechazado, el organismo notificado competente tomará las medidas adecuadas para impedir su puesta en el mercado. En caso de rechazo frecuente de lotes, el organismo notificado podrá suspender la verificación estadística.
El fabricante podrá, bajo la responsabilidad del organismo notificado, colocar el número de identificación de este último durante la fabricación.
7. Disposiciones administrativas.–El fabricante o su representante autorizado deberá tener a disposición de las autoridades nacionales por un período de al menos 5 años y, en el caso de productos implantables, de al menos 15 años después de que haya sido fabricado el último producto:
La declaración de conformidad.
La documentación contemplada en el punto 2.
Los certificados contemplados en los puntos 5.2 y 6.4.
En su caso el certificado de examen de tipo contemplado en el anexo III.
8. Aplicación a los productos de la clase IIa.–El presente anexo podrá aplicarse, con arreglo al apartado 1.c) del artículo 13, a los productos de la clase IIa como sigue:
8.1 No obstante lo dispuesto en los apartados 1 y 2, el fabricante asegurará y declarará mediante la declaración de conformidad que los productos de la clase IIa se fabrican con arreglo a la documentación técnica contemplada en el apartado 3 del anexo VII y cumplen los requisitos de este real decreto que les son aplicables.
8.2 No obstante lo dispuesto en los apartados 1, 2, 5 y 6, las verificaciones efectuadas por el organismo notificado tendrán como objeto la conformidad de los productos de la clase IIa con la documentación técnica contemplada en el apartado 3 del anexo VII.
9. Aplicación a los productos contemplados en el apartado 5 del artículo 3.–En el caso del apartado 5, al término de la fabricación de cada lote de productos contemplados en el apartado 5 del artículo 3 y, en caso de realizar la verificación prevista en el apartado 6, el fabricante informará al organismo notificado de la liberación de este lote de productos y le remitirá el certificado oficial de liberación del lote del derivado de sangre humana utilizado en dicho producto expedido por un laboratorio estatal o un laboratorio designado a tal fin por un Estado miembro, con arreglo al artículo 114, apartado 2, de la Directiva 2001/83/CE.
(Garantía de calidad de la producción)
1. El fabricante se cerciorará de que se aplica el sistema de calidad aprobado para la fabricación y efectuará la inspección final de los productos considerados tal como se especifica en el apartado 3, y estará sometido al control al que se hace referencia en el apartado 4.
2. La declaración CE de conformidad es el procedimiento mediante el cual el fabricante que cumple las obligaciones del punto 1 garantiza y declara que los productos en cuestión son conformes al tipo descrito en el certificado de examen CE de tipo y se ajustan a las disposiciones de este real decreto que les son aplicables.
El fabricante colocará el marcado CE con arreglo a lo establecido en el artículo 12 y hará una declaración escrita de conformidad. Esta declaración se referirá a uno o más productos sanitarios fabricados, identificados claramente mediante el nombre del producto, el código del producto u otra referencia inequívoca, y deberá ser conservada por el fabricante.
3. Sistema de calidad.
3.1 El fabricante presentará una solicitud de evaluación de su sistema de calidad ante un organismo notificado.
Dicha solicitud deberá contener:
El nombre y la dirección del fabricante.
Toda la información pertinente sobre los productos o las categorías de productos objeto del procedimiento.
Una declaración escrita en la que se especifique que no se ha presentado ante otro organismo notificado ninguna solicitud relativa a los mismos productos.
La documentación relativa al sistema de calidad.
Un compromiso de cumplir las obligaciones que se deriven del sistema de calidad que se apruebe.
Un compromiso de mantener el sistema de calidad aprobado de forma que se garantice siempre su adecuación y eficacia.
Si ha lugar, la documentación técnica relativa a los tipos aprobados y una copia de los certificados de examen CE de tipo.
Un compromiso por parte del fabricante de establecer y mantener actualizado un procedimiento sistemático para revisar la experiencia adquirida con los productos en la fase posterior a la producción, incluidas las disposiciones a que se refiere el anexo X, y para emplear los medios adecuados para aplicar las medidas correctivas que resulten necesarias. El compromiso incluirá la obligación, por parte del fabricante, de informar a las autoridades competentes sobre los siguientes hechos tan pronto como tenga conocimiento de los mismos:
i. Cualquier funcionamiento defectuoso o alteración de las características y/o las prestaciones, así como cualquier inadecuación del etiquetado o de las instrucciones de utilización de un producto que pueda dar lugar o haya podido dar lugar a la muerte o la alteración grave del estado de salud de un paciente o de un usuario.
ii. Cualquier razón de carácter técnico o sanitario ligada a las características o las prestaciones de un producto por las razones indicadas en el anterior inciso i que haya inducido al fabricante a realizar una acción sistemática sobre productos del mismo tipo.
3.2 La aplicación del sistema de calidad deberá garantizar la conformidad de los productos con el tipo descrito en el certificado de examen CE de tipo.–Todos los elementos, requisitos y disposiciones adoptados por el fabricante para su sistema de calidad deberán figurar en una documentación sistemática y ordenada en forma de políticas y de procedimientos escritos. La documentación del sistema de calidad deberá hacer posible una interpretación uniforme de la política y de los procedimientos de calidad aplicados, tales como los programas, planes, manuales y registros relativos a la calidad.
Deberá contener, en particular, una descripción adecuada de:
a) Los objetivos de calidad del fabricante.
b) La organización de la empresa y, en particular:
De las estructuras organizativas, de las responsabilidades de los directivos y su autoridad para la organización en lo referente a la fabricación de los productos.
De los medios para controlar el funcionamiento eficaz del sistema de calidad y, en particular, su aptitud para dar lugar al nivel deseado de calidad de los productos, incluido el control de los productos no conformes.
De los métodos de control de la eficacia del funcionamiento del sistema de calidad, en particular del tipo y el alcance del control aplicado a un tercero, en caso de que sea un tercero quien fabrique y/o lleve a cabo la inspección final y el ensayo de los productos o de sus componentes.
c) Las técnicas de control y de garantía de calidad en el proceso de fabricación y, en especial:
de los procesos y procedimientos que se utilizarán en lo relativo, sobre todo, a la esterilización, las compras y los documentos pertinentes;
de los procedimientos de identificación del producto establecidos y actualizados, a partir de dibujos, especificaciones u otros documentos aplicables, a lo largo de todas las etapas de fabricación.
d) Los exámenes y ensayos adecuados que se realizarán antes, durante y después de la producción, la frecuencia con que se llevarán a cabo y los equipos de prueba utilizados; la calibración de los equipos de ensayo debe ser tal que pueda comprobarse de forma adecuada.
3.3 El organismo notificado efectuará una auditoría del sistema de calidad para determinar si reúne los requisitos contemplados en el apartado 3.2. Dará por supuesta la conformidad con dichos requisitos si los sistemas de calidad cumplen las normas armonizadas correspondientes.
Al menos uno de los miembros del equipo encargado de la evaluación deberá tener experiencia en la evaluación de la tecnología de que se trate. El procedimiento de evaluación incluirá una inspección de las instalaciones del fabricante y, en caso debidamente justificado, de las instalaciones de los proveedores del fabricante, para controlar los procedimientos de fabricación.
Se comunicará la decisión al fabricante después de la inspección final. En la decisión figurarán las conclusiones de la inspección y una evaluación motivada.
3.4 El fabricante comunicará al organismo notificado que haya aprobado el sistema de calidad cualquier proyecto de adaptación importante de dicho sistema.
El organismo notificado evaluará las modificaciones propuestas y comprobará si el sistema de calidad así modificado reúne los requisitos contemplados en el apartado 3.2.
La decisión será notificada al fabricante previa recepción de la información antes citada y se expondrán en ella las conclusiones de la inspección y una evaluación justificada.
4. Control.
4.1 El objeto del control es garantizar el correcto cumplimiento por parte del fabricante de las obligaciones que se deriven del sistema de calidad aprobado.
4.2 El fabricante deberá autorizar al organismo notificado a efectuar todas las inspecciones necesarias y le facilitará toda la información pertinente, en particular:
la documentación sobre el sistema de calidad,
la documentación técnica,
los datos previstos en la parte del sistema de calidad relativa a la fabricación, tales como los informes referentes a las inspecciones, los ensayos, las calibraciones, la cualificación del personal correspondiente, etcétera.
4.3 El organismo notificado realizará periódicamente las inspecciones y evaluaciones adecuadas a fin de cerciorarse de que el fabricante aplica el sistema de calidad aprobado, y facilitará al fabricante un informe de evaluación.
4.4 El organismo notificado podrá asimismo visitar sin previo aviso al fabricante. Con ocasión de tales visitas, el organismo notificado podrá efectuar o hacer que se efectúen ensayos para verificar el buen funcionamiento del sistema de calidad, cuando lo considere necesario y entregará al fabricante un informe de inspección y, si se hubiera efectuado algún ensayo, un informe de ensayo.
5. Disposiciones administrativas.
5.1 El fabricante o su representante autorizado tendrá a disposición de las autoridades nacionales durante al menos cinco años y en caso de los productos implantables, de al menos 15 años después de que se haya fabricado el último producto:
la declaración de conformidad,
la documentación contemplada en el cuarto guión del apartado 3.1,
las adaptaciones contempladas en el apartado 3.4,
la documentación contemplada en el séptimo guión del apartado 3.1,
las decisiones e informes del organismo notificado contemplados en los apartados 4.3 y 4.4,
en su caso, el certificado de examen de tipo contemplado en el anexo III.
6. Aplicación a los productos de la clase IIa.–El presente anexo podrá aplicarse, con arreglo al apartado 1.c) del artículo 13, a los productos de la clase IIa como sigue:
6.1 No obstante lo dispuesto en los apartados 2, 3.1 y 3.2, el fabricante asegurará y declarará, mediante la declaración de conformidad, que los productos de la clase IIa se fabrican de conformidad con la documentación técnica contemplada en el apartado 3 del anexo VII, y cumplen los requisitos de este real decreto que les son aplicables.
6.2 Para los productos de la clase IIa, el organismo notificado evaluará, como parte de la evaluación contemplada en el apartado 3.3, la documentación técnica descrita en el apartado 3 del anexo VII, al menos respecto de una muestra representativa de cada subcategoría de productos, por lo que se refiere al cumplimiento de las disposiciones de este real decreto.
6.3 Para escoger la muestra o muestras representativas, el organismo notificado tendrá en cuenta la novedad de la tecnología, las similitudes de diseño, la tecnología, los métodos de fabricación y esterilización, la finalidad prevista y los resultados de las evaluaciones anteriores pertinentes (por ejemplo, de propiedades físicas, químicas o biológicas) efectuadas conforme a este real decreto. El organismo notificado documentará y pondrá a disposición de la autoridad competente los fundamentos en que se basa para escoger la muestra o muestras.
6.4 El organismo notificado evaluará otras muestras como parte de la evaluación de control contemplada en el apartado 4.3.
7. Aplicación a los productos contemplados en el apartado 5 del artículo 3.–Al término de la fabricación de cada lote de productos contemplados en el apartado 5 del artículo 3, el fabricante informará al organismo notificado de la liberación de este lote de productos y le remitirá un certificado oficial de liberación del lote de las sustancias derivadas de la sangre humana utilizado en dicho producto, expedido por un laboratorio estatal o un laboratorio designado a tal fin por un Estado miembro, con arreglo al artículo 114, apartado 2, de la Directiva 2001/83CE.
(Garantía de calidad del producto)
1. El fabricante se cerciorará de que se aplica el sistema de calidad aprobado para la inspección final del producto y los ensayos, tal como se especifica en el apartado 3, y estará sometido al control a que se hace referencia en el apartado 4.
Además, cuando se trate de productos puestos en el mercado en condiciones de esterilidad, y únicamente para los aspectos de la fabricación destinados a la obtención de la condición de esterilidad y a su mantenimiento, el fabricante aplicará las disposiciones de los apartados 3 y 4 del anexo V.
2. La declaración de conformidad CE es el procedimiento mediante el cual el fabricante que cumple las obligaciones impuestas por el apartado 1 garantiza y declara que los productos en cuestión son conformes al tipo descrito en el certificado de examen CE de tipo y se ajustan a las disposiciones del real decreto que les son aplicables.
El fabricante colocará el marcado CE con arreglo a lo establecido en el artículo 12 y hará una declaración escrita de conformidad. Esta declaración se referirá a uno o más productos sanitarios fabricados, claramente identificados mediante el nombre del producto, código del producto u otra referencia inequívoca y deberá ser conservada por el fabricante. El marcado CE irá acompañado del número de identificación del organismo notificado que realiza las funciones contempladas en el presente anexo.
3. Sistema de calidad.
3.1 El fabricante presentará una solicitud de evaluación de su sistema de calidad ante un organismo notificado.
Dicha solicitud deberá contener:
El nombre y apellidos y la dirección del fabricante.
Toda la información pertinente sobre los productos o la categoría de productos objeto del procedimiento.
Una declaración escrita en la que especifique que no se ha presentado ante otro organismo notificado ninguna solicitud relativa a los mismos productos.
La documentación relativa al sistema de calidad.
Un compromiso por parte del fabricante de cumplir las obligaciones que se deriven del sistema de calidad que se apruebe.
Un compromiso por parte del fabricante de velar por que el sistema de calidad aprobado continúe siendo adecuado y eficaz.
Si ha lugar, la documentación técnica relativa a los tipos aprobados y una copia de los certificados de examen CE de tipo.
El compromiso por parte del fabricante de establecer y mantener al día un procedimiento sistemático para revisar la experiencia adquirida con los productos en la fase posterior a la producción incluidas las disposiciones que a que se refiere el anexo X, y para emplear los medios adecuados para aplicar las medidas correctivas que resulten necesarias. El compromiso incluirá la obligación, por parte del fabricante, de informar a las autoridades competentes sobre los siguientes hechos tan pronto como tenga conocimiento de los mismos:
i. Cualquier funcionamiento defectuoso o alteración de las características o de las prestaciones, así como cualquier inadecuación del etiquetado o de las instrucciones de utilización de un producto que pueda dar lugar o haya podido dar lugar a la muerte o la alteración grave del estado de salud de un paciente o de un usuario.
ii. Cualquier razón de carácter técnico o sanitario ligada a las características o las prestaciones de un producto por las razones indicadas en el anterior inciso i que haya inducido al fabricante a realizar una acción sistemática sobre productos del mismo tipo.
3.2 De acuerdo con el sistema de calidad, se examinará cada producto o una muestra representativa de cada lote y se realizarán los ensayos adecuados definidos en la norma o normas pertinentes contempladas en el artículo 6, o bien ensayos equivalentes, con el fin de garantizar su conformidad con el tipo descrito en el certificado de examen CE de tipo y con los requisitos aplicables de este real decreto. Todos los elementos, requisitos y disposiciones adoptados por el fabricante deberán figurar en una documentación sistemática y ordenada en forma de medidas, procedimientos e instrucciones escritas. Esta documentación sobre el sistema de calidad permitirá una interpretación uniforme de los programas, planes, manuales y expedientes de calidad.
En especial, incluirá una descripción adecuada de:
los objetivos de calidad, la estructura organizativa las responsabilidades de los directivos y sus poderes en lo que respecta a la calidad de los productos;
los controles y ensayos que se realizarán después de la fabricación la calibración de los equipos de ensayo debe ser tal que pueda comprobarse de forma adecuada;
los medios para verificar el funcionamiento eficaz del sistema de calidad;
los expedientes de calidad, tales como los informes de inspección y los datos de los ensayos, los datos de calibración, los informes sobre la cualificación del personal correspondiente, etcétera.
los métodos de control de la eficacia del funcionamiento del sistema de calidad, en particular del tipo y el alcance del control aplicado al tercero en cuestión, en caso de que sea un tercero quien lleve a cabo la inspección final y el ensayo de los productos o de sus componentes.
Las verificaciones mencionadas anteriormente no se aplicarán a los aspectos de fabricación que tengan relación con la obtención de la esterilidad.
3.3 El organismo notificado efectuará una auditoría del sistema de calidad para determinar si cumple los requisitos contemplados en el apartado 3.2. Dará por supuesto el cumplimiento de dichos requisitos si los sistemas de calidad aplican las normas armonizadas correspondientes.
Al menos uno de los miembros del equipo encargado de la evaluación deberá tener experiencia en la evaluación de la tecnología de que se trate. El procedimiento de evaluación incluirá una inspección de las instalaciones del fabricante y, en caso justificado, de las instalaciones de los proveedores del fabricante, para controlar los procedimientos de fabricación.
Se comunicará la decisión al fabricante y en la misma figurarán las conclusiones del control y una evaluación motivada.
3.4 El fabricante comunicará al organismo notificado que haya aprobado el sistema de calidad cualquier proyecto de adaptación importante de dicho sistema.
El organismo notificado evaluará las modificaciones propuestas y comprobará si el sistema de calidad así modificado reúne los requisitos contemplados en el apartado 3.2.
La decisión será notificada al fabricante previa recepción de la información antes citada y se expondrán en ella las conclusiones del control y una evaluación motivada.
4. Control.
4.1 El objeto del control es garantizar el correcto cumplimiento por parte del fabricante de las obligaciones que se derivan del sistema de calidad aprobado.
4.2 El fabricante deberá autorizar al organismo notificado a acceder, con el fin de inspeccionarlas, a las instalaciones de inspección, ensayo y almacenamiento, y le facilitará toda la información pertinente, en particular:
la documentación sobre el sistema de calidad;
la documentación técnica;
los expedientes de calidad, tales como los informes referentes a las inspecciones y los datos de ensayos, los datos de calibración, los informes sobre la cualificación del personal correspondiente, etcétera.
4.3 El organismo notificado realizará periódicamente las inspecciones y evaluaciones adecuadas a fin de cerciorarse de que el fabricante aplica el sistema de calidad, y facilitará un informe de evaluación al fabricante.
4.4 El organismo notificado podrá asimismo visitar sin previo aviso al fabricante. Con ocasión de tales visitas, el organismo notificado, si lo considerase necesario, podrá efectuar o hacer que se efectúen ensayos para verificar el buen funcionamiento del sistema de calidad y la conformidad de la producción con los requisitos de este real decreto que le son aplicables. A tal fin, se controlará una muestra adecuada de productos terminados, tomada «in situ» por el organismo notificado, y se efectuarán los ensayos adecuados definidos en la norma o normas aplicables contempladas en el artículo 6 o ensayos equivalentes. En caso de que uno o varios ejemplares de los productos controlados no sean conformes, el organismo notificado adoptará las medidas oportunas.
El organismo notificado entregará al fabricante un informe de inspección y, en su caso, un informe de ensayo.
5. Disposiciones administrativas.
5.1 El fabricante o su representante autorizado tendrá a disposición de las autoridades nacionales por un periodo de al menos cinco años y, en el caso de los productos implantables, de al menos 15 años después de que haya sido fabricado el último producto:
la declaración de conformidad,
la documentación contemplada en el séptimo guión del apartado 3.1
las adaptaciones contempladas en el apartado 3.4,
las decisiones e informes del organismo notificado contemplados en el último párrafo del apartado 3.4 y en los apartados 4.3 y 4.4,
en su caso, el certificado de conformidad contemplado en el anexo III.
6. Aplicación a los productos de la clase IIa.–El presente anexo podrá aplicarse, con arreglo al apartado 1.c) del artículo 13, a los productos de la clase IIa como sigue:
6.1 No obstante lo dispuesto en los apartados 2, 3.1 y 3.2, el fabricante asegurará y declarará, mediante la declaración de conformidad, que los productos de la clase IIa se fabrican con arreglo a la documentación técnica contemplada en el apartado 3 del anexo VII y responden a los requisitos de este real decreto que les son aplicables.
6.2 Para los productos de la clase IIa, el organismo notificado evaluará, como parte de la evaluación contemplada en el apartado 3.3, la documentación técnica descrita en el anexo VII, apartado 3, al menos respecto de una muestra representativa de cada subcategoría de productos, por lo que se refiere al cumplimiento de las disposiciones de este real decreto.
6.3 Para escoger la muestra o muestras representativas, el organismo notificado tendrá en cuenta la novedad de la tecnología, las similitudes de diseño, la tecnología, métodos de fabricación y esterilización, la finalidad prevista y los resultados de las evaluaciones anteriores pertinentes (por ejemplo, de propiedades físicas, químicas o biológicas) efectuadas conforme a este real decreto. El organismo notificado documentará y pondrá a disposición de la autoridad competente los fundamentos en que se basa para escoger la muestra o muestras.
6.4 El organismo notificado evaluará otras muestras como parte de la evaluación contemplada en el apartado 4.3.
1. La declaración CE de conformidad es el procedimiento por el que el fabricante o su representante autorizado que cumple las obligaciones del apartado 2 y, en el caso de los productos estériles y los que tengan función de medición, las del apartado 5, garantiza y declara que los productos correspondientes cumplen las disposiciones de este real decreto que les son aplicables.
2. El fabricante preparará la documentación técnica descrita en el apartado 3; el fabricante, o su representante autorizado mantendrá esta documentación, incluida la declaración de conformidad, a disposición de las autoridades nacionales; con fines de inspección, durante al menos cinco años a partir de la fecha de fabricación del último producto. En el caso de los productos implantables, el período deberá ser de al menos quince años después de que haya sido fabricado el último producto.
3. La documentación técnica deberá hacer posible la evaluación de la conformidad del producto con los requisitos de la presente disposición e incluirá, en particular:
una descripción general del producto, incluidas las variantes previstas; y su finalidad o finalidades previstas;
dibujos de diseño, métodos de fabricación previstos, así como esquemas de los componentes, subconjuntos, circuitos, etc.;
las descripciones y explicaciones necesarias para la comprensión de los dibujos y esquemas mencionados y del funcionamiento del producto;
los resultados del análisis de riesgos, así como una lista de las normas contempladas en el artículo 6 aplicadas total o parcialmente, y una descripción de las soluciones adoptadas para cumplir los requisitos esenciales del real decreto cuando las normas contempladas en el artículo 6 no se apliquen en su totalidad;
para los productos estériles, una descripción de los métodos utilizados; y el informe de validación.
los resultados de los cálculos de diseño, de los controles efectuados, etc. Cuando un producto haya de conectarse a otro u otros productos para poder funcionar con arreglo a su finalidad prevista, deberá aportarse la prueba de que el primer producto se ajusta a los requisitos esenciales cuando está conectado a cualquiera de esos productos que posea las características indicadas por el fabricante;
las soluciones adoptadas con arreglo al anexo I, título I, punto 2;
la evaluación preclínica;
la evaluación clínica con arreglo al anexo X;
las etiquetas y las instrucciones de utilización.
4. El fabricante establecerá y mantendrá al día un procedimiento sistemático para revisar la experiencia adquirida con los productos en la fase posterior a la producción, incluidas las disposiciones contempladas en el anexo X y para emplear los medios adecuados para aplicar las medidas correctivas que resulten necesarias, teniendo en cuenta la naturaleza y los riesgos relacionados con el producto. El fabricante deberá informar a las autoridades competentes sobre los siguientes hechos tan pronto como tenga conocimiento de los mismos:
i. Cualquier funcionamiento defectuoso o alteración de las características o de las prestaciones, así como cualquier inadecuación del etiquetado o de las instrucciones de utilización de un producto que pueda dar lugar o haya podido dar lugar a la muerte o la alteración grave del estado de salud de un paciente o de un usuario.
ii. Cualquier razón de carácter técnico o sanitario ligada a las características o las prestaciones de un producto por las razones indicadas en el anterior inciso i que haya inducido al fabricante a realizar una acción sistemática sobre productos del mismo tipo.
5. Para los productos puestos en el mercado en condiciones de esterilidad y para los productos con función de medición de la clase I, el fabricante, además de lo dispuesto en el presente anexo, deberá seguir uno de los procedimientos contemplados en los anexos II, IV, V o VI. La aplicación de los anexos citados y la intervención del organismo notificado se limitarán:
en el caso de productos puestos en el mercado en condiciones de esterilidad, únicamente a los aspectos de la fabricación que se refieran a la obtención y mantenimiento de las condiciones de esterilidad;
en el caso de productos con función de medición, únicamente a los aspectos de la fabricación relativos a la conformidad de los productos con los requisitos metrológicos.
Se aplicará el apartado 6.1 del presente anexo.
6. Aplicación a los productos de la clase IIa.–El presente anexo podrá aplicarse, con arreglo al apartado 1.c) del artículo 13, a los productos de la clase IIa con la siguiente excepción:
6.1 Cuando el presente anexo se aplique en combinación con el procedimiento contemplado en los anexos IV, V o VI, la declaración de conformidad contemplada en el apartado 1 del presente anexo y la contemplada en los demás anexos citados constituirán una única declaración. Por lo que respecta a la declaración basada en el presente anexo, el fabricante asegurará y declarará que el diseño del producto cumple las disposiciones de este real decreto que le son aplicables.
1. Para los productos a medida o los productos destinados a investigaciones clínicas, el fabricante o su representante autorizado elaborarán esta declaración con los elementos especificados en el apartado 2.
2. La declaración comprenderá las indicaciones siguientes:
2.1 Para los productos a medida:
El nombre y la dirección del fabricante.
Los datos que permitan identificar al producto en cuestión.
La afirmación de que el producto se destina a ser utilizado exclusivamente por un paciente determinado, y el nombre de dicho paciente, un acrónimo o un código numérico.
El nombre del médico o de la persona autorizada que haya hecho la prescripción correspondiente y, en su caso, el nombre del centro sanitario.
Las características específicas del producto indicadas en la prescripción.
La declaración de que el producto en cuestión se ajusta a los requisitos esenciales enunciados en el anexo I de este real decreto y, en su caso, la indicación de los requisitos esenciales que no se hayan cumplido completamente, indicando los motivos.
2.2 Para los productos destinados a investigaciones clínicas contempladas en el anexo X:
Los datos que permitan identificar el producto en cuestión.
El plan de investigación clínica.
El manual del Investigador.
La confirmación del seguro u otra garantía financiera de los sujetos del ensayo, en los términos que se establecen en el artículo 8 del Real Decreto 223/2004, de 6 de febrero.
Los documentos utilizados para obtener el consentimiento informado.
Una declaración que indique si el producto incorpora o no como parte integrante, una sustancia o una sustancia derivada de la sangre humana contemplada en el punto 7.4 del anexo I.
Una declaración que indique si se han utilizado o no en la fabricación del producto tejidos de origen animal de conformidad con el anexo XIII de este real decreto.
El dictamen del comité de ética correspondiente con indicación de los aspectos que sean objeto de dicho dictamen.
El nombre del médico o la persona autorizada a tal fin y el de la institución responsable de las investigaciones.
El lugar, la fecha de inicio y la duración prevista de las investigaciones.
Una declaración por la que se haga constar que el producto de que se trate cumple los requisitos esenciales, con excepción de los aspectos objeto de las investigaciones, y que, en cuanto a estos últimos, se han adoptado todas las precauciones para proteger la salud y seguridad del paciente.
3. El fabricante se comprometerá también a mantener a disposición de las autoridades competentes:
3.1 En lo relativo a los productos a medida, la documentación que indique el lugar o lugares de fabricación y que permita comprender el diseño, la fabricación y las prestaciones del producto, incluidas las prestaciones previstas de manera que puede evaluarse su conformidad con los requisitos de este real decreto.
El fabricante adoptará todas las medidas necesarias para que el procedimiento de fabricación garantice la conformidad de los productos fabricados con la documentación mencionada en el primer párrafo.
3.2 En lo relativo a los productos destinados a investigaciones clínicas, la documentación incluirá:
una descripción general del producto; y de su finalidad prevista;
los dibujos de diseño, métodos de fabricación previstos, especialmente en materia de esterilización, y esquemas de los componentes, subconjuntos, circuitos, etc.;
las descripciones y explicaciones necesarias para la comprensión de los dibujos y esquemas mencionados y del funcionamiento del producto;
los resultados del análisis de riesgos, así como una lista de las normas contempladas en el artículo 6, aplicadas total o parcialmente, y una descripción de las soluciones adoptadas para cumplir los requisitos esenciales de la presente disposición, cuando no se apliquen las normas contempladas en el artículo 6;
si el producto contiene, como parte integrante, una sustancia o una sustancia derivada de la sangre humana contemplada en el anexo I, punto 7.4, los datos relativos a las pruebas realizadas al respecto y que son necesarias para evaluar la seguridad, calidad y utilidad de dicha sustancia, o sustancia derivada de la sangre humana, teniendo en cuenta la finalidad prevista del producto;
si se han utilizado en la fabricación del producto tejidos de origen animal de conformidad con la Directiva 2003/32/CE, las medidas de gestión del riesgo que se han aplicado en este contexto para reducir el riesgo de infección;
los resultados de los cálculos de diseño, de los controles y de los ensayos técnicos efectuados, etc.
El fabricante tomará todas las medidas necesarias para que el procedimiento de fabricación garantice la conformidad de los productos fabricados con la documentación mencionada en el primer párrafo del presente punto.
El fabricante autorizará la evaluación o, en su caso, la verificación de la eficacia de estas medidas.
4. La información que figure en las declaraciones a que se refiere el presente anexo deberá conservarse durante un período de al menos cinco años. En el caso de los productos implantables, el período será al menos de 15 años.
5. Por lo que se refiere a los productos a medida, el fabricante deberá comprometerse a revisar y documentar la experiencia adquirida con los productos en la fase posterior a la producción, incluidas las disposiciones a que se refiere el anexo X, y a emplear los medios adecuados para aplicar las medidas correctoras que resulten necesarias. El compromiso incluirá la obligación, por parte del fabricante de informar a las autoridades competentes sobre los siguientes hechos tan pronto como tenga conocimiento de los mismos así como sobre las medidas correctoras que procedan:
i. Cualquier funcionamiento defectuoso o alteración de las características o de las prestaciones, así como cualquier inadecuación del etiquetado o de las instrucciones de utilización de un producto que pueda dar lugar o haya podido dar lugar a la muerte o al deterioro grave del estado de salud de un paciente o de un usuario.
ii. Cualquier razón de carácter técnico o sanitario relacionada con las características o las prestaciones de un producto que, por los motivos mencionados en el inciso i, haya inducido al fabricante a realizar una acción sistemática sobre productos del mismo tipo.
I. Definiciones
1. Definiciones en relación con las reglas de clasificación.
1.1 Duración.
Uso pasajero: Destinados normalmente a utilizarse de forma continua durante menos de sesenta minutos.
Uso a corto plazo: Destinados normalmente a utilizarse de forma continua durante un período de hasta treinta días.
Uso prolongado: Destinados normalmente a utilizarse de forma continua durante un período de más de treinta días.
1.2 Productos invasivos.
Producto invasivo: Producto que penetra parcial o completamente en el interior del cuerpo bien por un orificio corporal o bien a través de la superficie corporal.
Orificio corporal: Cualquier abertura natural del cuerpo, así como la superficie externa del globo ocular, o una abertura artificial creada de forma permanente, como un estoma.
Producto invasivo de tipo quirúrgico: Producto invasivo que penetra en el interior del cuerpo a través de la superficie corporal por medio de una intervención quirúrgica o en el contexto de una intervención quirúrgica.
A los efectos de este real decreto, los productos distintos de los aludidos en el párrafo anterior y cuya penetración no se produzca a través de uno de los orificios corporales reconocidos serán considerados productos invasivos de tipo quirúrgico.
Producto implantable.
Cualquier producto diseñado:
para ser implantado totalmente en el cuerpo humano, o
para sustituir una superficie epitelial o la superficie ocular.
Mediante intervención quirúrgica y destinado a permanecer allí después de la intervención.
Se considerará asimismo producto implantable cualquier producto destinado a ser introducido parcialmente en el cuerpo humano mediante intervención quirúrgica y a permanecer allí después de dicha intervención durante un período de al menos treinta días.
1.3 Instrumento quirúrgico reutilizable.–Instrumento destinado a fines quirúrgicos para cortar, perforar, serrar, escarificar, raspar, pinzar, retraer, recortar u otros procedimientos similares, sin estar conectado a ningún producto sanitario activo, y que puede volver a utilizarse una vez efectuados todos los procedimientos pertinentes.
1.4 Producto sanitario activo.–Cualquier producto sanitario cuyo funcionamiento dependa de una fuente de energía eléctrica o de cualquier fuente de energía distinta de la generada directamente por el cuerpo humano o por la gravedad, y que actúe mediante conversión de dicha energía. No se considerarán productos sanitarios activos los productos sanitarios destinados a transmitir, sin ninguna modificación significativa, energía, sustancias u otros elementos de un producto sanitario activo al paciente. Los programas informáticos autónomos se consideran un producto sanitario activo.
1.5 Producto activo terapéutico.–Cualquier producto sanitario activo utilizado solo o en combinación con otros productos sanitarios, destinado a sostener, modificar, sustituir o restaurar funciones o estructuras biológicas en el contexto del tratamiento o alivio de una enfermedad, lesión o deficiencia.
1.6 Producto activo para diagnóstico.–Cualquier producto sanitario activo utilizado solo o en combinación con otros productos sanitarios, destinado a proporcionar información para la detección, el diagnóstico, el control o el tratamiento de estados fisiológicos, de estados de salud, de enfermedades o de malformaciones congénitas.
1.7 Sistema circulatorio central.–En el marco de este real decreto se entenderá por sistema circulatorio central» los vasos siguientes:
Arterias pulmonares, aorta ascendente, cayado aórtico, aorta descendente hasta la bifurcación aórtica, arterias coronarias, arteria carótida primitiva, arteria carótida externa, arteria carótida interna, arterias cerebrales, tronco braquiocefálico, venas coronarias, venas pulmonares, vena cava superior, vena cava inferior.
1.8 Sistema nervioso central.–En el marco de este real decreto se entenderá por «sistema nervioso central» el cerebro, las meninges y la médula espinal.
II. Normas de desarrollo
2. Normas de desarrollo.
2.1 La aplicación de las reglas de clasificación se regirá por la finalidad prevista de los productos.
2.2 Si un producto se destina a utilizarse en combinación con otro producto, las reglas de clasificación se aplicarán a cada uno de los productos por separado. Los accesorios se clasificarán por sí solos, por separado del producto con el que se utilicen.
2.3 Los soportes informáticos que sirvan para manejar un producto o que tengan influencia en su utilización se incluirán automáticamente en la misma categoría.
2.4 Si un producto no se destina a utilizarse exclusiva o principalmente en una parte específica del cuerpo, se considerará para la clasificación su utilización especificada más crítica.
2.5 Si para el mismo producto son aplicables varias reglas teniendo en cuenta las prestaciones que le atribuye el fabricante, se aplicarán las reglas que conduzcan a la clasificación más elevada.
2.6 Para el cálculo de la duración mencionada en el título I, punto 1.1., por utilización continua se entenderá una utilización efectiva ininterrumpida del producto para la finalidad prevista. Sin embargo, cuando la utilización de un producto se interrumpa para sustituirlo inmediatamente por el mismo producto o un producto idéntico, esto se considerará una extensión de la utilización continua del producto.
III. Clasificación
1. Productos no invasivos.
1.1 Regla 1.–Todos los productos no invasivos se incluirán en la clase I, salvo que sea aplicable alguna de las reglas siguientes.
1.2 Regla 2.–Todos los productos no invasivos destinados a la conducción o almacenamiento de sangre, fluidos o tejidos corporales, líquidos o gases destinados a una perfusión, administración o introducción en el cuerpo entrarán en la clase IIa:
Si pueden conectarse a un producto sanitario activo de la clase IIa o de una clase superior.
Si están destinados a ser utilizados para el almacenamiento o canalización de sangre u otros fluidos o para el almacenamiento de órganos, partes de órganos o tejidos corporales.
En todos los demás casos se incluirán en la clase I.
1.3 Regla 3.–Todos los productos no invasivos destinados a modificar la composición biológica o química de la sangre, de otros fluidos corporales o de otros líquidos destinados a introducirse en el cuerpo se incluirán en la clase IIb, salvo si el tratamiento consiste en filtración, centrifugación o intercambios de gases o de calor, en cuyo caso se incluirán en la clase IIa.
1.4 Regla 4.–Todos los productos no invasivos que entren en contacto con la piel lesionada:
Se clasificarán en la clase I si están destinados a ser utilizados como barrera mecánica, para la compresión o para la absorción de exudados.
Se clasificarán en la clase IIb si se destinan principalmente a utilizarse con heridas que hayan producido una ruptura de la dermis y sólo puedan cicatrizar por segunda intención.
Se incluirán en la clase IIa en todos los demás casos, incluidos los productos destinados principalmente a actuar en el microentorno de una herida.
2. Productos invasivos.
2.1 Regla 5.–Todos los productos invasivos en relación con los orificios corporales, salvo los productos invasivos de tipo quirúrgico, que no estén destinados a ser conectados a un producto sanitario activo o que estén destinados a ser conectados a un producto sanitario activo de la clase I:
Se incluirán en la clase I si se destinan a un uso pasajero.
Se incluirán en la clase IIa si se destinan a un uso a corto plazo, salvo si se utilizan en la cavidad oral hasta la faringe, en el conducto auditivo externo hasta el tímpano o en una cavidad nasal, en cuyo caso se incluirán en la clase I.
Se incluirán en la clase IIb si se destinan a un uso prolongado, salvo si se utilizan en la cavidad oral hasta la faringe, en el conducto auditivo externo hasta el tímpano o en una cavidad nasal, y no pueden ser absorbidos por la membrana mucosa, en cuyo caso se incluirán en la clase IIa.
Todos los productos invasivos en relación con los orificios corporales, salvo los productos invasivos de tipo quirúrgico, que se destinen a conectarse a un producto sanitario activo de la clase IIa o de una clase superior, entrarán en la clase IIa.
2.2 Regla 6.–Todos los productos invasivos de tipo quirúrgico destinados a un uso pasajero entrarán en la clase IIa salvo que:
Se destinen específicamente a controlar, diagnosticar, vigilar o corregir una alteración cardiaca o del sistema circulatorio central por contacto directo con estas partes del cuerpo, en cuyo caso se incluirán en la clase III.
Sean instrumentos quirúrgicos reutilizables, en cuyo caso se incluirán en la clase I.
Estén destinados a utilizarse específicamente en contacto directo con el sistema nervioso central, en cuyo caso se incluirán en la clase III.
Se destinen a suministrar energía en forma de radiaciones ionizantes, en cuyo caso se incluirán en la clase IIb.
Se destinen a ejercer un efecto biológico o a ser absorbidos totalmente o en gran parte, en cuyo caso se incluirán en la clase IIb.
Se destinen a la administración de medicamentos mediante un sistema de suministro, si ello se efectúa de manera potencialmente peligrosa teniendo en cuenta el modo de aplicación, en cuyo caso se incluirán en la clase IIb.
2.3 Regla 7.–Todos los productos invasivos de tipo quirúrgico destinados a un uso a corto plazo se incluirán en la clase IIa salvo que tengan por finalidad:
Específicamente, controlar, diagnosticar, vigilar o corregir una alteración cardiaca o del sistema circulatorio central por contacto directo con estas partes del cuerpo, en cuyo caso se incluirán en la clase III; o
Utilizarse, específicamente, en contacto directo con el sistema nervioso central, en cuyo caso se incluirán en la clase III; o
Suministrar energía en forma de radiaciones ionizantes, en cuyo caso se incluirán en la clase IIb; o
Ejercer un efecto biológico o ser absorbidos, totalmente o en gran parte, en cuyo caso se incluirán en la clase III; o
Experimentar modificaciones químicas en el organismo, salvo si los productos se colocan dentro de los dientes, o administrar medicamentos, en cuyo caso se incluirán en la clase IIb.
2.4 Regla 8.–Todos los productos implantables y los productos invasivos de uso prolongado de tipo quirúrgico se incluirán en la clase IIb salvo que se destinen:
A colocarse dentro de los dientes, en cuyo caso se incluirán en la clase IIa.
A utilizarse en contacto directo con el corazón, el sistema circulatorio central o el sistema nervioso central, en cuyo caso se incluirán en la clase III.
A ejercer un efecto biológico o ser absorbidos totalmente o en gran parte, en cuyo caso se incluirán en la clase III.
A sufrir modificaciones químicas en el organismo, salvo si los productos se colocan dentro de los dientes, o a la administración de medicamentos, en cuyo caso se incluirán en la clase III.
3. Reglas adicionales aplicables a los productos activos.
3.1 Regla 9.–Todos los productos terapéuticos activos destinados a administrar o intercambiar energía se incluirán en la clase IIa salvo si sus características son tales que puedan administrar energía al cuerpo humano o intercambiarla con el mismo de forma potencialmente peligrosa, teniendo en cuenta la naturaleza, la densidad y el punto de aplicación de la energía, en cuyo caso se incluirán en la clase IIb.
Todos los productos activos destinados a controlar el funcionamiento de los productos terapéuticos activos de la clase IIb o destinados a influir directamente en el funcionamiento de dichos productos se incluirán en la clase IIb.
3.2 Regla 10.–Todos los productos activos con fines de diagnóstico se incluirán en la clase IIa:
Si se destinan a suministrar energía que vaya a ser absorbida por el cuerpo humano, excluidos los productos cuya función sea la iluminación del organismo del paciente en el espectro visible.
Si se destinan a crear una imagen de la distribución in vivo de fármacos radiactivos.
Si se destinan a permitir un diagnóstico directo o la vigilancia de procesos fisiológicos vitales a no ser que se destinen específicamente a la vigilancia de parámetros fisiológicos vitales, cuando las variaciones de esos parámetros, por ejemplo las variaciones en el funcionamiento cardíaco, la respiración, la actividad del SNC, puedan suponer un peligro inmediato para la vida del paciente, en cuyo caso se incluirán en la clase IIb.
Los productos activos destinados a emitir radiaciones ionizantes y que se destinen a la radiología con fines diagnósticos y terapéuticos, incluidos los productos para controlar o vigilar dichos productos, o que influyan directamente en el funcionamiento de los mismos, se incluirán en la clase IIb.
Regla 11.–Todos los productos activos destinados a administrar medicamentos, líquidos corporales u otras sustancias al organismo, o a extraerlos del mismo, se incluirán en la clase IIa, a no ser que ello se efectúe de forma potencialmente peligrosa, teniendo en cuenta la naturaleza de las sustancias, la parte del cuerpo de que se trate y el modo de aplicación, en cuyo caso se incluirán en la clase IIb.
3.3 Regla 12.–Todos los demás productos activos se incluirán en la clase I.
4. Reglas especiales.
4.1 Regla 13.–Todos los productos que incorporen como parte integrante una sustancia que, si se utilizara independientemente, podría considerarse como un medicamento según la definición que figura en el artículo 1 de la Directiva 2001/83/CE, y que pueda ejercer sobre el cuerpo humano una acción accesoria a la de los productos, se incluirán en la clase III.
Todos los productos que incorporen, como parte integrante del mismo, una sustancia derivada de la sangre humana, se incluirán en la clase III.
4.2 Regla 14.–Todos los productos utilizados con fines anticonceptivos o para la prevención de la transmisión de enfermedades transmisibles por contacto sexual se considerarán productos de la clase IIb, a menos que sean productos implantables o invasivos de uso prolongado, en cuyo caso se incluirán en la clase III.
4.3 Regla 15.–Todos los productos destinados específicamente a usos de desinfección, limpieza, enjuague o, en su caso, a la hidratación de lentes de contacto, se incluirán en la clase IIb.
Todos los productos que se destinen específicamente a la desinfección de productos sanitarios se incluirán en la clase IIa, a no ser que estén destinados específicamente a la desinfección de productos invasivos, en cuyo caso se incluirán en la clase IIb.
La presente regla no se aplicará a productos destinados a la limpieza de productos sanitarios que no sean lentes de contacto mediante acción física.
4.4 Regla 16.–Los productos destinados específicamente al registro de imágenes radiográficas de diagnóstico se incluirán en la clase IIa.
4.5 Regla 17.–Todos los productos elaborados utilizando tejidos animales o derivados de los mismos que hayan sido transformados en inviables se incluirán en la clase III, excepto en los casos en que los productos estén destinados a entrar en contacto únicamente con piel intacta.
5. Regla 18.–No obstante lo dispuesto en otras reglas, las bolsas para sangre se incluirán en la clase IIb.
1. Disposiciones generales.
1.1 Como norma general, la confirmación del cumplimiento de los requisitos relativos a las características y prestaciones contempladas en el anexo I, apartados 1 y 3, en condiciones normales de utilización de un producto, así como la evaluación de los efectos secundarios y de la aceptabilidad de la relación beneficio-riesgo mencionada en el anexo I, apartado 6, deberán basarse en datos clínicos. La evaluación de estos datos, en lo sucesivo denominada ‹evaluación clínica›, teniendo en cuenta, en su caso, las normas armonizadas pertinentes, deberá seguir un procedimiento definido y metodológicamente adecuado basado:
1.1.1 Bien en una evaluación crítica de las publicaciones científicas pertinentes disponibles en ese momento sobre la seguridad, las prestaciones, las características de diseño y la finalidad prevista del producto, cuando:
esté demostrada la equivalencia del producto con el producto al que se refieren los datos, y
los datos demuestren adecuadamente la conformidad con los requisitos esenciales pertinentes.
1.1.2 Bien en una evaluación crítica de los resultados de todas las investigaciones clínicas realizadas.
1.1.3 Bien en una evaluación crítica de la combinación de los datos clínicos proporcionados en 1.1.1 y 1.1.2.
1.1 bis. Cuando se trate de productos implantables y de productos de la clase III, se realizarán investigaciones clínicas, a no ser que esté debidamente justificado basarse en los datos clínicos existentes.
1.1 ter. La evaluación clínica y sus resultados deberán documentarse. Esta documentación y/o sus referencias completas se incluirán en la documentación técnica del producto.
1.1 quáter. La evaluación clínica y su documentación se actualizarán activamente con datos obtenidos del plan de seguimiento post-comercialización. Cuando el seguimiento clínico posterior a la comercialización en el marco del plan de seguimiento post-comercialización no se considere necesario, ello deberá justificarse y documentarse debidamente.
1.1 quinquies. Cuando la demostración de la conformidad con los requisitos esenciales sobre la base de los datos clínicos no se considere necesaria, toda exclusión en este sentido deberá justificarse adecuadamente a partir de los resultados de la gestión del riesgo y teniendo en cuenta las especificidades de la interacción entre el producto y el cuerpo, las prestaciones clínicas previstas y las afirmaciones del fabricante. La adecuación de la demostración de la conformidad con los requisitos esenciales basada en la evaluación de las prestaciones, ensayos en bancos de pruebas y la evaluación preclínica deberá justificarse debidamente.
1.2 Todos los datos deberán considerarse confidenciales con arreglo a lo dispuesto en el artículo 7.
2. Investigaciones clínicas.
2.1 Objetivos.–Los objetivos de las investigaciones clínicas serán:
verificar que, en condiciones normales de utilización, las prestaciones de los productos son conformes a las contempladas en el apartado 3 del anexo I; y
determinar los posibles efectos secundarios indeseables en condiciones normales de utilización y evaluar si éstos constituyen riesgos en relación con las prestaciones atribuidas al producto.
2.2 Consideraciones éticas.–Las investigaciones clínicas se realizarán con arreglo a la Declaración de Helsinki, adoptada en 1964 por la decimoctava Asamblea médica mundial en Helsinki (Finlandia) modificada en último lugar por la Asamblea médica mundial. Es imperativo que se aplique el espíritu de la Declaración de Helsinki a todas las disposiciones relativas a la protección de las personas, y esto en cada una de las etapas de las investigaciones clínicas, desde la primera reflexión sobre la necesidad y la justificación del estudio hasta la publicación de los resultados.
2.3 Métodos.
2.3.1 Las investigaciones clínicas se efectuarán según un plan de pruebas adecuado y correspondiente al estado de la ciencia y de la técnica del momento, definido de forma que se confirmen o se refuten las afirmaciones del fabricante a propósito del producto; estas investigaciones incluirán un número de observaciones suficiente para garantizar la validez científica de las conclusiones.
2.3.2 Los procedimientos utilizados para realizar las investigaciones se adaptarán al producto examinado.
2.3.3 Las investigaciones clínicas se efectuarán en condiciones similares a las condiciones normales de utilización del producto.
2.3.4 Se examinarán todas las características pertinentes, incluidas las relativas a la seguridad, a las prestaciones del producto y a los efectos sobre el paciente.
2.3.5 Se registrarán íntegramente y se comunicarán inmediatamente a todas las autoridades competentes de los Estados miembros en los que se esté efectuando la investigación clínica todos los acontecimientos adversos graves.
2.3.6 Las investigaciones se efectuarán en un entorno adecuado bajo la responsabilidad de un médico o de otra persona que posea las cualificaciones y esté autorizada a tal fin.
El médico o la persona autorizada tendrán acceso a los datos técnicos y clínicos relativos al producto.
2.3.7 El informe escrito, firmado por el médico o por la persona autorizada responsable, contendrá una evaluación crítica de todos los datos obtenidos durante las investigaciones clínicas.
3. Muestras.
a) Las muestras de productos sanitarios para ser utilizadas en las investigaciones clínicas serán proporcionadas gratuitamente por el promotor. En determinadas situaciones se podrán autorizar otras formas de suministro.
Todas las muestras sobrantes serán devueltas al promotor, una vez finalizada la investigación.
b) Las etiquetas y manual de instrucciones de las muestras para utilización en investigaciones clínicas deberán estar redactadas en la lengua española oficial del Estado y permitirán en cualquier momento la perfecta identificación de los productos.
c) El promotor conservará en el archivo principal del ensayo los protocolos de fabricación y control de los lotes de productos fabricados para la investigación clínica.
d) Los Servicios de Farmacia del Hospital supervisarán el suministro de las muestras que vayan a ser utilizadas en la investigación clínica.
1. El organismo notificado, su director y el personal encargado de realizar las operaciones de evaluación y verificación no podrán ser ni el diseñador, ni el fabricante, ni el proveedor, ni el instalador, ni el usuario de los productos que controlen, ni el representante de ninguna de estas personas. No podrán intervenir, ni directamente ni como representantes, en el diseño, construcción, comercialización o mantenimiento de estos productos. Esto no excluye la posibilidad de que se intercambie información técnica entre el fabricante y el organismo.
2. El organismo y el personal encargado del control deberán realizar las operaciones de evaluación y verificación con la máxima integridad profesional y con la competencia requerida en el sector de los productos sanitarios y deberán estar libres de toda presión e incitación, en particular de orden económico, que pueda influir en su juicio o en los resultados del control, especialmente de las presiones procedentes de personas o grupos de personas interesadas en los resultados de las verificaciones.
Cuando un organismo notificado confíe trabajos específicos a un subcontratista en relación con la observación y verificación de hechos, deberá asegurarse previamente de que el subcontratista cumple con lo dispuesto en el real decreto y, especialmente, en el presente anexo. El organismo notificado tendrá a disposición de las autoridades nacionales los documentos pertinentes relativos a la evaluación de la competencia del subcontratista y a los trabajos efectuados por este último en el ámbito de este real decreto.
3. El organismo notificado tendrá que ser capaz de realizar el conjunto de las tareas asignadas en uno de los anexos II a VI a los organismos de este tipo y para las que haya sido notificado, independientemente de que estas tareas sean efectuadas por el propio organismo o bajo su responsabilidad. En particular, tendrá que disponer del personal y poseer los medios necesarios para cumplir adecuadamente las tareas técnicas y administrativas ligadas a la ejecución de las evaluaciones y verificaciones. Ello presupone la disponibilidad de personal científico suficiente en el seno de la organización, que posea la experiencia adecuada y los conocimientos necesarios para evaluar, desde un punto de vista médico, la funcionalidad y las prestaciones de los productos que le hayan sido notificados, en relación con los requisitos de este real decreto y, en particular, con los requisitos del anexo I. Asimismo, tendrá que tener acceso al equipo para realizar las verificaciones requeridas.
4. El personal encargado de los controles deberá poseer:
Una buena formación profesional relativa al conjunto de las operaciones de evaluación y verificaciones para las que el organismo haya sido designado.
Un conocimiento satisfactorio de las prescripciones relativas a las inspecciones que efectúe y una práctica suficiente de dichos controles.
La aptitud necesaria para redactar los certificados, actas e informes que constituyan la materialización de los controles efectuados.
5. Deberá garantizarse la independencia del personal encargado del control. La remuneración de cada agente no deberá depender ni del número de controles que efectúe ni del resultado de dichos controles.
6. El organismo deberá suscribir un seguro de responsabilidad civil, a menos que dicha responsabilidad sea cubierta por la Administración estatal, o que los controles sean efectuados directamente por Organismos públicos.
7. El personal del organismo encargado de los controles estará vinculado por el secreto profesional en relación con todo lo que llegue a su conocimiento en el ejercicio de sus funciones (salvo en relación con las autoridades administrativas competentes del Estado español) en el ámbito de este real decreto o de cualquier disposición de derecho interno adoptada en aplicación de la misma.
El marcado CE de conformidad consistirá en las iniciales «CE» presentadas en la siguiente forma:
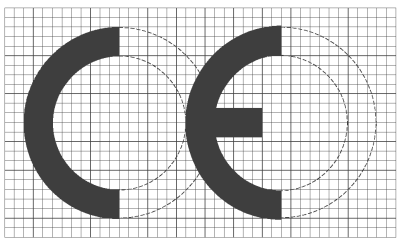
Si el marcado se reduce o amplía deberán mantenerse las proporciones indicadas en el esquema graduado que figura más arriba.
Los distintos componentes del marcado CE deberán tener, básicamente, la misma dimensión vertical, que no podrá ser inferior a 5 milímetros.
Podrá no cumplirse este requisito de dimensión mínima en casos de productos de pequeñas dimensiones.
1. Análisis y gestión del riesgo.
1.1. Justificación del uso de tejidos o derivados de origen animal.–Basándose en su análisis del riesgo y en su estrategia de gestión del riesgo global para un producto sanitario determinado, el fabricante justificará la decisión de utilizar los tejidos o derivados de origen animal a los que se refiere el apartado 3 del artículo 5 (especificando las especies animales y los tejidos), teniendo en cuenta el beneficio clínico esperado, el riesgo residual potencial y las alternativas apropiadas.
1.2. Procedimiento de evaluación.–Con el objeto de garantizar un alto nivel de protección a los pacientes o usuarios, el fabricante de productos para cuya elaboración se utilicen tejidos o derivados de origen animal a los que se refiere el apartado 1.1 deberá llevar a cabo un análisis del riesgo y una estrategia de gestión del riesgo adecuados y bien documentados, para abordar todos los aspectos pertinentes relativos a las EET. Asimismo, identificará los peligros asociados a dichos tejidos o derivados, elaborará la documentación sobre las medidas adoptadas para reducir al máximo el riesgo de transmisión y demostrará la aceptabilidad del riesgo residual asociado al producto para cuya elaboración se utilicen tales tejidos o derivados, teniendo en cuenta el uso al que está destinado el producto y las ventajas que aporta.
La seguridad de un producto, en lo que se refiere a su potencial para propagar un agente transmisible, depende de todos los factores descritos en los apartados 1.2.1 a 1.2.7, que deberán ser analizados, evaluados y gestionados. La combinación de tales medidas determina la seguridad del producto.
Deberán tenerse en cuenta dos etapas clave, a saber:
La selección de los materiales de partida (tejidos o derivados) considerados adecuados de acuerdo con su contaminación potencial con agentes transmisibles (véanse los apartados 1.2.1, 1.2.2 y 1.2.3), teniendo en cuenta los tratamientos posteriores.
La aplicación de un procedimiento de producción para eliminar o inactivar agentes transmisibles presentes en los tejidos o derivados controlados en origen (véase el apartado 1.2.4).
Además, se tendrán en cuenta las características del producto y el uso al que dicho producto esté destinado (véanse los apartados 1.2.5, 1.2.6 y 1.2.7).
A la hora de proceder al análisis del riesgo y a la aplicación de la estrategia de gestión del riesgo, deberá prestarse la debida atención a los dictámenes de los comités científicos pertinentes y, cuando proceda, a los dictámenes del Comité de especialidades farmacéuticas cuyas referencias se hayan publicado en el «Diario Oficial de la Unión Europea».
1.2.1 Los animales como fuente de material.–El riesgo de EET está relacionado con las especies y las razas, así como con la naturaleza del tejido de partida. Habida cuenta de que la acumulación de la infecciosidad de EET se produce en un período de incubación de varios años, el abastecimiento a partir de animales jóvenes sanos se considera un factor de reducción del riesgo. Deberán excluirse los animales de riesgo, como los encontrados muertos, los que han sido sacrificados en situaciones de emergencia y los sospechosos de padecer EET.
1.2.2 Origen geográfico.–A la espera de la clasificación de los países en función de su calificación sanitaria respecto de la EEB, prevista en el Reglamento (CE) núm. 999/2001 del Parlamento Europeo y del Consejo, de 22 de mayo de 2001, por el que se establecen disposiciones para la prevención, el control y la erradicación de determinadas encefalopatías espongiformes transmisibles, publicado en el «Diario Oficial de la Unión Europea» de 31 de mayo de 2001, a la hora de valorar el riesgo de un país de origen se utilizará el riesgo geográfico de EEB. El riesgo geográfico de EEB es un indicador cualitativo de la probabilidad de que existan uno o más bovinos infectados por la EEB, tanto en el nivel preclínico como clínico, en un momento dado, en un país determinado. Cuando se confirma dicha presencia, el riesgo geográfico de EEB aporta una indicación del nivel de infección con arreglo a lo especificado en el cuadro siguiente:
|
Nivel de riesgo geográfico de EEB |
Presencia de uno o más bovinos infectados, clínica o preclínicamente, por el agente de la EEB en una región geográfica o país |
|---|---|
|
I |
Sumamente improbable |
|
II |
Improbable, pero no se descarta |
|
III |
Probable, pero sin confirmar o confirmado a un nivel inferior |
|
IV |
Confirmado a un nivel superior |
Algunos factores influyen en el riesgo geográfico de infección de EEB relacionado con el uso de tejidos en estado bruto o derivados, procedentes de un país determinado. Dichos factores se definen en el apartado 1 del artículo 2.3.13.2 del Código Zoosanitario Internacional de la OIE (Oficina Internacional de Epizootias), disponible en la página web www.oie.int/esp/normes/mcode/E_00067.htm.
El Comité director científico ha evaluado el riesgo geográfico de EEB de varios países terceros y Estados miembros, y seguirá haciéndolo con todos los países que solicitaron su calificación sanitaria respecto de la EEB, teniendo en cuenta los principales factores de la OIE.
1.2.3 Naturaleza del tejido de partida.–El fabricante deberá tener en cuenta la clasificación de los riesgos relacionados con los diferentes tipos de tejidos de partida. La identificación del origen del tejido animal se someterá al control y a la inspección individual por parte de un veterinario y la carcasa del animal deberá obtener la certificación de apta para el consumo humano.
El fabricante deberá garantizar que no existe ningún riesgo de contaminación cruzada en el momento del sacrificio.
El fabricante no utilizará tejidos o derivados de origen animal considerados de elevado potencial de infecciosidad de EET, a menos que su utilización sea necesaria en circunstancias excepcionales, es decir, que aporten un gran beneficio al paciente y que no existan tejidos de partida alternativos.
Además, se aplicará lo dispuesto en el Reglamento (CE) núm. 1774/2002 del Parlamento Europeo y del Consejo, de 3 de octubre de 2002, por el que se establecen las normas sanitarias aplicables a los subproductos animales no destinados al consumo humano.
1.2.3.1 Ovinos y caprinos.–Se ha elaborado una clasificación de la infecciosidad para tejidos de ovinos y caprinos basándose en los conocimientos actuales, sobre los agentes transmisibles en tejidos y líquidos orgánicos de ovinos y caprinos infectados de manera natural por la tembladera clínica. El dictamen del Comité director científico adoptado en la reunión de 22 y 23 de julio de 1999 y titulado «The policy of breeding and genotyping of sheep» (Política de reproducción y genotipo de oveja) (disponible en el sitio web de la Comisión http://europa. eu.int/comm/food/fs/sc/ssc/outcome_en.html) incluye, en su anexo, un cuadro que más tarde se actualizaría en el dictamen TSE infectivity distribution in ruminant tissues (state of knowledge, December 2001)» (TSE distribución de la capacidad infectiva en los tejidos de rumiantes) adoptado en la reunión de 10 y 11 de enero de 2002 (disponible en el sitio web de la Comisión http://europa. eu.int/comm/food/fs/sc/ssc/outcome_en.html).
La clasificación podrá revisarse a la luz de nuevas pruebas científicas (por ejemplo, utilizando dictámenes pertinentes de los comités científicos, del Comité de especialidades farmacéuticas, así como medidas de la Comisión Europea que regulen el uso de material con riesgo de EET). En el »Diario Oficial de la Unión Europea» se publicará un análisis de las referencias a los documentos o dictámenes pertinentes y se establecerá una lista, una vez que la Comisión Europea haya adoptado una decisión.
1.2.3.2 Bovinos.–La lista de material especificado de riesgo que figura en el Reglamento (CE) núm. 999/2001 se considerará de elevado potencial de infecciosidad de EET.
1.2.4 Inactivación o eliminación de agentes transmisibles.
1.2.4.1 En lo que se refiere a los productos que no puedan resistir un proceso de inactivación o eliminación sin sufrir una degradación inaceptable, el fabricante se apoyará principalmente en el control del origen.
1.2.4.2 En cuanto al resto de los productos, si el fabricante declara que los procesos de fabricación son capaces de eliminar o inactivar agentes transmisibles, deberá demostrarlo mediante la documentación adecuada.
La información pertinente procedente de una investigación y un análisis de la literatura científica adecuados podrá utilizarse para justificar los factores de inactivación o eliminación cuando los procesos específicos mencionados en la bibliografía sean comparables a los utilizados para el producto. La investigación y el análisis también deberán tener en cuenta los posibles dictámenes científicos disponibles elaborados por un Comité científico de la UE. Dichos dictámenes servirán de referencia en caso de que existan posturas divergentes.
Cuando la investigación bibliográfica no sirva para demostrar lo declarado, el fabricante realizará un estudio específico con base científica sobre la inactivación o la eliminación, teniendo en cuenta lo siguiente:
El riesgo identificado relativo al tejido.
La identificación de los agentes modelo pertinentes.
La justificación de la elección de combinaciones concretas de agentes modelo.
La identificación de la fase elegida para eliminar o inactivar los agentes transmisibles.
El cálculo de los factores de reducción.
Un informe final identificará los parámetros de fabricación y los límites que son críticos para la eficacia del proceso de inactivación o eliminación.
Se aplicarán procedimientos documentados adecuados para garantizar el respeto de los parámetros validados durante la fabricación de rutina.
1.2.5 Cantidades de tejidos de partida o derivados de origen animal necesarios para fabricar una unidad del producto sanitario.–El fabricante deberá evaluar la cantidad de tejido en estado bruto o derivados de origen animal necesarios para fabricar una sola unidad del producto sanitario. En caso de proceso de purificación, el fabricante evaluará si éste pudiera concentrar los niveles de agentes transmisibles presentes en los tejidos de partida o derivados de origen animal.
1.2.6 Tejidos o derivados de origen animal que entran en contacto con los pacientes y usuarios.–El fabricante deberá tener en cuenta:
i. La cantidad de tejido o derivado de origen animal.
ii. La zona de contacto: su superficie, tipo (piel, mucosas, cerebro, etc.), y estado (sano o dañado, por ejemplo).
iii. El tipo de tejido o derivado que entra en contacto con el paciente o el usuario.
iv. El tiempo que el producto está destinado a permanecer en contacto con el cuerpo (incluido el efecto de reabsorción).
Se tendrá en cuenta la cantidad del producto sanitario que puede utilizarse en un procedimiento determinado.
1.2.7 Vía de administración.–El fabricante tendrá en cuenta la vía de administración recomendada en la información relativa al producto, desde el riesgo más elevado hasta el más bajo.
1.3 Revisión de la evaluación.–El fabricante establecerá y mantendrá un procedimiento sistemático para revisar la información obtenida sobre su producto sanitario u otros productos similares en la fase posterior a la fabricación.
Se evaluará la información para determinar su posible pertinencia en materia de seguridad, concretamente:
a) Si se detectan riesgos no reconocidos anteriormente.
b) Si el riesgo estimado derivado de un peligro determinado ya no es aceptable.
c) Si la evaluación original se ha invalidado por otras razones.
En caso de que se produzca una de las situaciones anteriores, deberán tenerse en cuenta los resultados de la evaluación en el proceso de gestión del riesgo.
A la vista de esta nueva información, se preverá un análisis de las medidas de gestión del riesgo para el producto (incluida la justificación de la elección de un tejido o derivado de origen animal). Si existe la posibilidad de que haya cambiado el riesgo residual o su aceptabilidad, habrá que volver a evaluar y justificar su impacto en las medidas de control del riesgo aplicadas anteriormente.
Los resultados de esta evaluación deberán documentarse.
2. Evaluación de los productos sanitarios de la clase III por parte de los organismos notificados.–En lo que se refiere a los productos pertenecientes a la clase III con arreglo a la regla 17 (todos los productos sanitarios para cuya elaboración se utilicen tejidos o derivados de origen animal transformados en inviables, excepto los productos destinados a entrar en contacto únicamente con piel intacta) del anexo IX de este real decreto, los fabricantes deberán facilitar a los organismos notificados toda la información pertinente que permita la evaluación de la estrategia de análisis y gestión de riesgos que estén aplicando. Cualquier información nueva sobre el riesgo de EET recogida por el fabricante y que tenga interés para sus productos deberá enviarse al organismo notificado para su información.
Cualquier cambio en relación con los procesos de abastecimiento, recogida, tratamiento e inactivación o eliminación que pueda modificar los resultados contenidos en el expediente de gestión del riesgo del fabricante deberá remitirse al organismo notificado a efectos de una aprobación adicional antes de su aplicación.
Este documento es de carácter informativo y no tiene valor jurídico.
Ayúdenos a mejorar: puede dirigir sus comentarios y sugerencias a nuestro Servicio de atención al ciudadano
Agencia Estatal Boletín Oficial del Estado
Avda. de Manoteras, 54 - 28050 Madrid